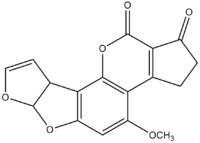
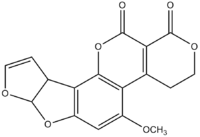
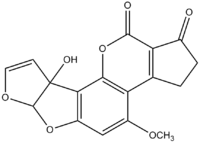
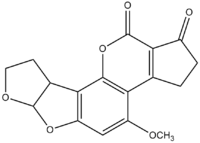
- Aflatoxine
-
Aflatoxine 
Général No CAS PubChem SMILES InChI Propriétés chimiques Formule brute C17H12O6 [Isomères] Masse molaire[1] 312,2736 ± 0,0162 g·mol-1
C 65,39 %, H 3,87 %, O 30,74 %,Précautions Classification du CIRC Groupe 1 : Cancérogène pour l'homme[2] Écotoxicologie DL50 1,75 mg·kg-1 singe, oral[3] Unités du SI & CNTP, sauf indication contraire. L'aflatoxine est une mycotoxine produite par des champignons proliférant sur des graines conservées en atmosphère chaude et humide. Elle est nuisible aussi bien chez l'homme que chez l'animal, et possède un pouvoir cancérigène élevé. Elle fut découverte en 1960 en Angleterre.
Sommaire
Production des aflatoxines
Les aflatoxines constituent un groupe de 18 composés structurellement proches (un assemblage d'une coumarine et de 3 furannes). Elles sont produites par Aspergillus flavus (qui produit aussi de l’aflatrem, de l’acide cyclopiazonique, de l’acide aspergillique), Aspergillus parasiticus et Aspergillus nomius. Ces micro-organismes ubiquitaires ont peu d’exigences de croissance : une température comprise entre 6 et 50 °C, une source de carbone et d’azote et une activité de l’eau supérieure à 80%. Cependant dans certaines conditions (température comprise entre 13 et 45 °C, humidité importante, présence de certains acides gras), ils peuvent produire des métabolites secondaires : les aflatoxines, qui sont donc des mycotoxines. Parmi les plus courantes, on trouve l'AFB1, l'AFB2, l'AFM1, l'AFG1 et l'AFG2.
Structures chimiques des principales aflatoxines Effets généraux des aflatoxines
De très nombreux produits alimentaires destinés à l’homme ou aux animaux peuvent contenir des aflatoxines en quantité parfois importante : graines d’arachides, maïs (en grain, ensilage, …), blé, céréales diverses, amandes, noisettes, noix, pistaches, figues, dattes, cacao, café, manioc, soja.... Les aflatoxines B1 et B2 (AFB1 et AFB2) sont les plus couramment rencontrées dans les aliments. Métabolisées par diverses enzymes microsomiales les aflatoxines sont éliminées sous forme glycurono et sulfo conjuguées par voie urinaire, par le lait ou la bile. Lors de la métabolisation des aflatoxines, certains dérivés époxydés hautement réactifs peuvent apparaître. Fortement électrophiles ils réagissent avec les groupements nucléophiles de l'ADN en s'intercalant entre les bases ou des protéines. Les aflatoxines ont de ce fait un fort effet tératogène et peuvent à hautes doses entraîner la mort en quelques heures à quelques jours selon la dose et la sensibilité de l'animal. Elles ont par ailleurs un rôle sur les phosphorylations et la lipogenèse, ainsi que des propriétés immunosuppressives. Enfin, les aflatoxines sont reconnues comme étant les plus puissants cancérigènes naturels. L’intoxication aiguë par les aflatoxines se traduit par la mort en général avec parfois des symptômes de dépression, anorexie, diarrhée, ictère ou anémie. Les lésions essentiellement hépatiques (nécroses, cirrhose) évoluent à long terme en hépatome ou carcinome. Les formes chroniques d’aflatoxicose se traduisent par une baisse des performances pour les animaux d’élevage, une anémie, un ictère léger et une évolution cancéreuse à terme. La présence de mycotoxines dans les aliments pose de gros problèmes d’hygiène publique et de santé animale. L'AFB1 est considérée comme la plus toxique des aflatoxines.
Toxicologie
Tableau 1. DL50 par voie orale de l’aflatoxine B1 Espèces animales DL50 (ug/kg) Lapin 0,3 Chat 0,6 Chien 0,5-1,0 Cochon 0,6 Babouin 2,0 Rat (mâle) 5,5 Rat (femelle) 17,9 Singe Macaque 7,8 Souris 9,0 Hamster 10,2 Humain 5,0* Le DL50 pour les humains provient d’une extrapolation d’une étude moléculaire et biologique. Elle provient d’un cas d’épidémie par empoisonnement en 1975 en Inde. Sur 1000 personnes qui avaient été contaminées par des aflatoxines dans du maïs, 10% en sont mortes. Toutefois, les cas d’empoisonnement aux aflatoxines sont rares. La toxicité chronique des aflatoxines est en revanche préoccupante, au vu de leurs effets cancérogènes. L'évaluation de la quantité de ces toxines dans la nourriture est donc l'objet d'études internationales depuis plusieurs décennies[4].
Les aflatoxines dans le lait
Chez le bétail, l’aflatoxine B1 absorbée avec des aliments contaminés est métabolisée au niveau du foie en un dérivé 4-hydroxy - appelé aflatoxine M1 - qui est chez les animaux laitiers (notamment vaches, brebis et chèvres) excrété dans le lait. Il existe de plus une relation linéaire entre la concentration de AFM1 excrétée et la quantité de AFB1 ingérée. Ainsi, il fut montré, chez la vache laitière, que 0.5 à 4% de l’aflatoxine B1 ingérée se retrouve sous forme d’aflatoxine M1 dans le lait. Cette mycotoxine conserve - à un moindre degré certes - les importantes propriétés cancérigènes de l’aflatoxine B1. Aussi, l’effet cumulatif lié à l’ingestion régulière et itérative de telles toxines fait courir de grands risques aux enfants et aux nourrissons grands consommateurs de laits et de produits laitiers. Ce risque est d’autant plus important que l’aflatoxine M1 résiste aux traitements usuels de conservation et de transformation des produits laitiers (chaleur, froid, lyophilisation...). On retrouve la presque totalité de l’aflatoxine M1 dans le lait écrémé, et dans les produits obtenus par précipitation lactique (yaourts, fromages blancs, crèmes lactées...), alors que l’on en retrouve très peu dans le beurre. Ceci est lié à la présence d’interactions hydrophobes entre l’aflatoxine M1 et les caséines, et de fait il est fréquent de constater un enrichissement des fromages initialement contaminés en aflatoxine M1 au cours de l’égouttage (les AFM1 se lient aux protéines du lait et sont donc plus concentrées dans le caillé que dans le lait frais et le petit lait). Actuellement, le taux maximal d'AFM1 autorisé dans le lait est de 50 ng/kg. Pour limiter la concentration des aflatoxines dans le lait, différentes mesures peuvent être prises en amont de la production des aliments destinés aux animaux laitiers :
- Un système de rotation des cultures assez long pour permettre l'assainissement des cultures;
- Une utilisation de variétés de maïs moins sensibles à la contamination fongique ou plus précoces;
- Un système de récolte qui évite de rompre les grains;
- Une analyse de l'ensilage utilisé pour l'alimentation des animaux (détection et/ou quantification de l'AFB1 dans des échantillons d'ensilage), et en cas de détection d'aflatoxines, un retrait du silo des parties présentant des signes de détérioration aérobie et un traitement de l'ensilage restant au propionate, additif alimentaire accélérant la fermentation. D'autres agents chimiques tels que les acides, les bases (ammoniaque, soude), des agents oxydants (peroxyde d'hydrogène, ozone), des agents réducteurs (bisulfites), des agents chlorés, du formaldéhyde peuvent aussi être utilisés pour dégrader ou biotransformer les aflatoxines. On peut également épandre un agent d’ensilage hydrodispersible contenant une souche de bactérie lactique brevetée : Lactobacillus buchneri NCIMB 40788, reconnue pour sa capacité à améliorer la stabilité aérobie (action antifongique) des ensilages à forte matière sèche. Cet agent est particulièrement recommandé pour les ensilages de maïs ouverts au printemps/été;
- Une couverture constante de l'ensilage;
- Dans le cas de grains de maïs, un séchage des grains avant l'entrepôt et un maintien du niveau d'humidité à 14 ou 15%;
- Une ventilation dans le dessiccateur à fourrage.
Une analyse régulière du lait et des produits laitiers (détection et/ou quantification de l'AFM1 à partir d'échantillons de lait frais, de lait en poudre reconstitué ou de fromage) permet également de limiter les risques d'intoxication.
Méthodes de détection et d’analyse
Étant donné qu’on retrouve les aflatoxines dans une vaste gamme de nourriture et considérant leurs effets toxiques chez les humains et les animaux, il devient alors très important d’avoir des méthodes de détections adéquates pour répondre aux diverses normes établies dans plusieurs pays. Plusieurs méthodes sont utilisées pour la détection des aflatoxines dans les produits agricoles. Par exemple, on retrouve la chromatographie sur couche mince, des méthodes de HPLC couplées à de la fluorescence et des techniques immunologiques. Une des plus récentes et efficaces est la chromatographie liquide couplée à la spectrométrie de masse (LC-MS) ou couplée à la spectrométrie de masse en tandem (LC-MS/MS).
Chromatographie liquide couplée à la spectrométrie de masse (LC-MS)
La technique d’analyse suivante sert à analyser les aflatoxines B1, B2, G1 et G2 dans des échantillons de produits d’agriculture.
- Préparation de l’échantillon
Il faut tout d’abord préparer les échantillons avant de procéder à l’analyse des aflatoxines. Ils doivent être préparés de manière à ce que l’extraction des aflatoxines soit optimale. Les échantillons tels des céréales, du riz, des fruits séchés ou des noix sont homogénéisés en poudre à l’aide d’un mélangeur. On utilise 0,5 g de poudre avec une quantité connue d’étalon interne, l’aflatoxine AFM1, afin de diminuer les erreurs expérimentales. L’aflatoxine AFM1 est un étalon interne de choix étant donné qu’il ne se retrouve pas dans les produits d’agriculture. Le tout subit une extraction liquide-liquide avec du méthanol 80% et est ensuite agité, puis centrifugé. Dans le cas des épices, il faut un traitement préalable pour éliminer le gras présent dans l’échantillon. Ce traitement consiste en une extraction à l’hexane. Les échantillons sont filtrés puis on met un volume d’échantillon dans l’auto-échantillonneur, le même volume d’un tampon tris-HCl (pH 7,2), et on finit le volume avec de l’eau distillé.
- Purification
Une méthode proposée pour extraire les aflatoxines de l’échantillon est une micro-extraction sur phase solide (SPME) « on-line », c'est-à-dire que l’extraction se fait automatiquement par l’appareil juste avant la chromatographie liquide. Plusieurs paramètres sont très importants pour que l’extraction ait un bon rendement. La phase stationnaire de la colonne capillaire (ex : Supel-Q PLOT) est conditionnée par deux cycles d’aspiration/éjection de méthanol et d’eau. Les échantillons font ensuite 25 cycles d’aspiration/éjection à un débit de 100uL/min. Finalement, les échantillons sont transportés automatiquement avec la phase mobile du LC-MS.
- Séparation et Analyse
L’analyse se fait ensuite par chromatographie liquide couplée à un spectromètre de masse. Tout d’abord, la chromatographie se fait en phase inversée (ex : Colonne Zorbax Eclipse XDB-C8). La phase mobile est composée de Méthanol/Acétonitrile (60/40, v/v): 5mM formate d’ammonium (45:55 v/v). Le formate d’ammonium favorise la protonation de la molécule étudiée lors de l’analyse spectrométrique. Le débit d’élution est de 1,0 mL/min ce qui permet une analyse de 8 minutes. Le détecteur, comme mentionné précédemment, est un spectromètre de masse. Ce type de détection nécessite une ionisation positive ou négative des analytes à la sortie de la colonne chromatographique. Celle-ci se fait à l’aide d’électro-nébulisation ionique (ESI). Dans le cas des aflatoxines, l’ionisation positive, sous la forme [M-H]+, est favorisée avec un bon rapport signal sur bruit (S/N). La méthode d’analyse par spectrométrie de masse est maintenant une méthode de choix quant à l’analyse des aflatoxines. Depuis la dernière décennie, cette méthode a permis d’améliorer les limites de détection en filtrant les masses des impuretés qui interfèrent dans des détecteurs spectrophotométriques par exemple[5],[6].
Tableau 2. Exemples de résultats d’analyse des aflatoxines dans les produits agricoles Aliments Détection AFB1 (ug/kg) AFB2 (ug/kg) AFG1 (ug/kg) AFG2 (ug/kg) Pays Référence Arachides LC/MS 0,48 N/D 0,84 1,12 Japon Journal of Chromatography A. 1216 (2009) 4416–4422. Amandes LC/MS N/D 0,11 N/D 0,34 Japon Journal of Chromatography A. 1216 (2009) 4416–4422. Noix de Coco LC/MS 0,65 N/D N/D 1,06 Japon Journal of Chromatography A. 1216 (2009) 4416–4422. Maïs LC/MSMS 2,7 2,2 3,3 3,4 Espagne Food Chemistry 117 (2009) 705–712. Figues LC/FD 5,6 0,5 2,8 2,3 Danemark Z Lebensm Unters Forsch A. 206 (1998) 243-245. - N/D: Non détecté
- LC/FD: Chromatographie liquide à détection de fluorescence
Les quantités d’aflatoxines retrouvées dans divers aliments dépendent de plusieurs facteurs. Dépendamment des normes de chaque pays et des méthodes d’entreposage, il est fréquent de voir une variation des quantités d’aflatoxines détectées.
Législation et protection
Beaucoup de pays à travers le monde ont établi des normes sur la quantité maximale d’aflatoxines qui doit être retrouvée dans la nourriture.
La législation européenne, émise en 1998 et modifiée en 2006, a pour objectif de ne pas dépasser une quantité nocive d’aflatoxine[7] quotidiennement, soit de 253 à 441 ng/kg, selon une étude américaine. Par exemple, elle fixe ainsi réglementairement[8] une limite de 2 μg/kg d’aflatoxines dans les arachides, les noix, les fruits séchés et les céréales en consommation humaine directe, et une limite de 15 μg/kg pour les « amandes et pistaches devant subir une opération avant utilisation comme ingrédient alimentaire » [9].
Au Canada et aux États-Unis, on retrouve des normes parfois moins sévères mais portant sur toute la nourriture destinée à la consommation humaine. Des normes sont aussi établies sur la quantité d’aflatoxines retrouvées dans la nourriture donnée à du bétail. Celles-ci sont de 20 ug/kg au Canada, tandis qu’aux États-Unis, elles varient de 20 à 300 ug/kg[4],[10].Tableau 3. Niveau toléré de l’aflatoxine B1 au niveau international Pays Quantité maximale (ug/kg) Produit Canada 15 Noix États-Unis 20 Toute la nourriture Union Européenne 2 Arachides, noix, fruits séchés et céréales Argentine 0 Arachides, maïs et produits Brésil 15 Toute la nourriture Chine 10 Riz et huile de table République Tchèque 5? Toute la nourriture Hongrie 5? Toute la nourriture Inde 30 Toute la nourriture Japon 10 Toute la nourriture Nigeria 20 Toute la nourriture Pologne 0 Toute la nourriture Afrique du Sud 5 Toute la nourriture Zimbabwe 5 Toute la nourriture Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- ChemIDplus
- Moss, M.O., Risk assessment for aflatoxins in foodstuffs, International Biodeterioration & Biodegradation, 50, (2002), p. 137 – 142.
- Shephard, G. S., Aflatoxin analysis at the beginning of the twenty-first century, Anal. Bioanal. Chem., 395, (2009), p. 1215–1224.
- Nonaka, Y. et al., Determination of aflatoxins in food samples by automated on-line in-tube solid-phase microextraction coupled with liquid chromatography–mass spectrometry, Journal of Chromatography A, 1216, (2009), p. 4416–442.
- EFSA European Food Safety Authority Les aflatoxines dans les denrées alimentaires
- Règlement (CE) No 1881/2006 portant fixation de teneurs maximales pour certains contaminants dans les denrées alimentaires-Annexe-Section 2:Mycotoxines
- Le règlement CE n°1881/2006 mentionne en particulier dans ses considérants que « Pour ce qui est des aflatoxines, le CSAH a déclaré dans son avis du 23 septembre 1994 qu’elles étaient des cancérogènes génotoxiques[…]. Compte tenu de cet avis, il convient de limiter la teneur totale en aflatoxines des denrées alimentaires (somme des teneurs en aflatoxines B1, B2, G1 et G2) ainsi que la seule teneur en aflatoxine B1, cette dernière étant de loin le composé le plus toxique. La possibilité d’une réduction de la teneur maximale actuelle en aflatoxine M1 des aliments pour nourrissons et enfants en bas âge devrait être envisagée au vu de l’évolution des procédures d’analyse»
- Charmley, L.L., Trenholm, H.L., Fact Sheet – Mycotoxins, Canadian Food Inspection Agency, [en ligne ], <http://www.inspection.gc.ca/english/anima/feebet/pol/mycoe.shtml>, (12 avril 2010).
Voir aussi
Liens externes
Bibliographie
One-Year Monitoring of Aflatoxins and Ochratoxin A in Tiger-Nuts and their Beverages ; Food Chemistry, online 9 January 2011
Catégories :- Toxine
- Cancérogène biologique
- Mycotoxine
- Coumarine
Wikimedia Foundation. 2010.