- Avancement De Réaction
-
Avancement de réaction
Avancement de réaction
L'avancement de réaction[1] (initialement introduit par Théophile de Donder sous le nom de "degré d'avancement") permet de caractériser l'état d'avancement d'une réaction entre son état initial (avant réaction) et son état final (après réaction). Il est noté par la lettre grecque ξ (ksi) et est défini par :
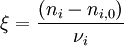 dans laquelle :
dans laquelle : 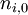 est la quantité initiale de la substance
est la quantité initiale de la substance 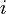 ;
; 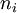 étant sa quantité dans l'état d'avancement considéré et
étant sa quantité dans l'état d'avancement considéré et 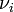 son coefficient stœchiométrique dont le signe est négatif si le constituant
son coefficient stœchiométrique dont le signe est négatif si le constituant 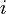 est un réactif de départ et positif si c'est un produit de la réaction[2].
est un réactif de départ et positif si c'est un produit de la réaction[2].L'avancement de réaction s'exprime en moles. Avant réaction :
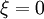
Sa valeur dépend de la manière d'écrire l'équation stœchiométrique de la réaction (ou équation bilan), il faut donc toujours indiquer cette dernière. Mais elle est indépendante de la substance choisie pour la calculer.
Une définition plus générale est donnée par :
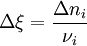 . Pour une variation élémentaire on a :
. Pour une variation élémentaire on a : 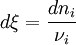 .
.Exemples de calcul
Considérons la réaction d'équation-bilan: 2 H2 + O2 = 2 H2O avec les quantités iniales suivantes : 2 moles de H2; 1 mole de O2 et 0 mole de H2O.
Lorsque 1 mole de H2 aura été consommée, il restera 0,5 mole de O2 et il se sera formé 1 mole de H2O
L'avancement de la réaction peut se calculer indifféremment par rapport à l'une quelconque des substances mises en jeu dans la réaction.
Par rapport à H2 :
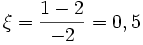 mol
molPar rapport à O2 :
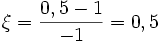 mol
molPar rapport à H2O :
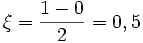 mol
molPar contre, si on avait écrit : H2 + 1/2O2 = H2O et avec les mêmes quantités initiales et transformées on aurait :
Par rapport à H2 :
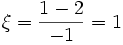 mol
molPar rapport à O2 :
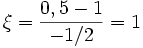 mol
molPar rapport à H2O :
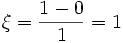 mol
molCe qui illustre que, pour des mêmes quantités initiales et transformées, la valeur de l'avancement de réaction dépend de la manière d'écrire l'équation bilan.
Notes et références
- Portail de la chimie
Catégorie : Thermochimie
Wikimedia Foundation. 2010.
