- Entropie De L'eau
-
Entropie de l'eau
L'entropie de l'eau est un cas intéressant d'entropie. Dans une molécule d'eau l'atome d'oxygène ayant deux doublets non liants, deux liaison hydrogène sont possibles ce qui fait de l'eau liquide un système très fortement associé.
la distance entre molécules d'eau liquide est plus importante entre -22 °C (eau surfondue extrême) et 4 °C, et c'est seulement à partir de 4 °C que, l'eau ayant dissocié une part de ses liaisons hydrogène, l'élévation de température à pression constante provoque une dilatation ordinaire suffisante pour compenser le relatif effondrement de l'association moléculaire. Le coefficient α de dilatation de l'eau est donc négatif pour T < 277K et positif au-delà (à la pression atmosphérique).
Du fait de la relation de Clapeyron (voir formules de thermodynamique), la variation de l'entropie à température constante est dS = -(1/T)VdP .αT.
Ce qui est contraire à l'intuition commune est :
comme on confine le système par l'augmentation de pression , ce confinement réduit le "Possible" dans l'espace de phase des états de translation, donc son logarithme ( rappel S = log (Possible) ) ; donc on doit réduire S par augmentation de pression.
Or ici le contraire se produit pour t < 4 °C. La raison en est simple : l'ordre dû aux liaisons hydrogène est ce qui maintient un volume plus grand à cause de l'association en quasi-ligne-droite de la laison hydrogène H---O-H ; l'augmentation de pression casse ces lignes droites et donc le désordre, ou plutôt disons le Possible, augmente.
Ainsi, conformément à la relation de Clapeyron
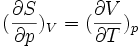 , la compréhension qualitative simultanée de ces deux anomalies est bien due à une seule et même cause : la "friabilité" des liaisons hydrogène. Ce que vient dire la formule de Clapeyron est : cette simultanéité est quantifiable exactement.
, la compréhension qualitative simultanée de ces deux anomalies est bien due à une seule et même cause : la "friabilité" des liaisons hydrogène. Ce que vient dire la formule de Clapeyron est : cette simultanéité est quantifiable exactement.Voir aussi
- Portail de la chimie
- Portail de l’eau
Catégories : Article à désacadémiser | Thermochimie | Eau
Wikimedia Foundation. 2010.
