- Effet Joule Thomson,
-
Effet Joule-Thomson
En physique, l'effet Joule-Thomson, également appelé effet Joule-Kelvin, est un phénomène lors duquel la température d'un gaz diminue lorsque ce gaz subit une expansion adiabatique.
L'effet a été baptisé d'après les physiciens James Prescott Joule et William Thomson (lord Kelvin). Ce dernier établit l'existence de cet effet en 1852 en poursuivant les travaux de Joule sur l'expansion de Joule, lors de laquelle un gaz subit une expansion à énergie interne constante.
Sommaire
Description du phénomène
Dans un gaz, la relation liant la température, la pression et le volume est décrite par les lois des gaz, dont la plus connue est la loi des gaz parfaits. Lorsque le volume du gaz augmente (le gaz subit une expansion), les lois des gaz déterminent notamment l'évolution de sa température et de sa pression. En général, lorsqu'un gaz subit une expansion adiabatique, sa température peut soit augmenter, soit diminuer, en fonction des conditions de température et de pression initiales. Pour une pression donnée, un gaz possède une Température d'inversion de Joule-Thomson, au-dessus de laquelle l'expansion occasionnera une augmentation de la température, et au-dessous de laquelle elle occasionnera une diminution de la température du gaz. Pour la plupart des gaz au voisinage de la pression atmosphérique, cette température d'inversion de Joule-Thomson est relativement élevée (nettement supérieure à la température ambiante), et le gaz peut donc être refroidi sous l'effet de l'expansion.
Lors d'une expansion, le rapport entre la variation de température ΔT et la variation de pression ΔP est appelé coefficient de Joule-Thomson μ :
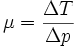
La température d'inversion de Joule-Thomson est la température pour laquelle le coefficient μ change de signe.
Effet Joule-Thomson négatif
Une exception notable à la règle selon laquelle la température décroît lorsque le gaz subit une expansion est l'hélium, dont la température d'inversion de Joule-Thomson à pression atmosphérique est d'environ 40 K (-233 °C). Le seul autre gaz dont la température augmente sous l'effet de l'expansion dans des conditions standards est l'hydrogène. La raison de ces exceptions est la suivante. Lors des collisions des atomes ou des molécules au sein du gaz, l'énergie cinétique est temporairement transformée en énergie potentielle. Cela implique qu'une diminution de la densité du gaz (lors de l'expansion) entraîne une diminution du nombre de collisions par unité de temps et donc une diminution de l'énergie potentielle, ce qui du fait de la conservation de l'énergie entraîne une augmentation de l'énergie cinétique et donc de la température. Dans le cas de l'hydrogène et de l'hélium, la conversion d'énergie potentielle et énergie cinétique fait plus que compenser l'augmentation d'énergie potentielle due aux forces électromagnétiques. ce ci devient une augmentation de l'énergie cinétique
Applications
L'effet Joule-Thomson est utilisé dans le procédé de réfrigération de Carl von Linde. C'est un procédé standard dans la pétrochimie, où le refroidissement occasionné lors de la compression est utilisé pour liquéfier un gaz (par exemple pour fabriquer de l'oxygène ou de l'azote liquide).
Bibliographie
- Zemansky, M.W. (1968) Heat and Thermodynamics, McGraw-Hill. , p.182, 335
- Schroeder, Daniel V. (2000) Thermal Physics, Addison Wesley Longman. , p.142
Articles connexes
- Portail de la physique
Catégories : Thermodynamique | Hydrogène
Wikimedia Foundation. 2010.
