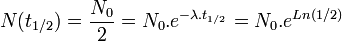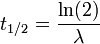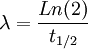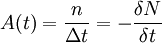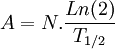- Décroissance Radioactive
-
Décroissance radioactive
La décroissance radioactive est la réduction du nombre de noyaux radioactifs (instables) dans un échantillon. La décroissance radioactive se produit jusqu'à ce que tous les noyaux de l'échantillon soient stables.
Un radionucléide quelconque a autant de chances de se désintégrer à un moment donné qu'un autre radionucléide de la même espèce, et la désintégration ne dépend pas des conditions physico-chimiques dans lesquelles le nucléide se trouve. En d'autres termes, la désintégration est régie par le hasard, et la loi de désintégration radioactive est une loi statistique.
Sommaire
Loi de désintégration radioactive
Soit N(t) le nombre de radionucléides d'un élément donné présents dans un échantillon à un instant t quelconque. Comme la probabilité de désintégration d'un de ces radionucléides ne dépend ni de la présence d'autres radionucléides ni du milieu environnant, le nombre total de désintégrations dN pendant un petit intervalle de temps dt à l'instant t est proportionnel au nombre de radionucléides N présents et à la durée dt de cet intervalle : c'est une loi de décroissance exponentielle. Mathématiquement, cette loi s'écrit sous la forme :
- dN = − λNdt
où la constante de proportionnalité λ, appelée constante radioactive du radionucléide considéré, possède la dimension de l'inverse d'un temps. On met le signe moins (–) parce que N diminue au cours du temps, de sorte que la constante λ est positive.
En intégrant l'équation différentielle précédente, on trouve le nombre N(t) de radionucléides présents dans le corps à un instant t quelconque, sachant qu'à un instant donné t = 0 il y en avait N0 :
N(t) = N0e − λt
Où:
- N0 est le nombre initial de noyaux non-désintégrés ;
- λ est la constante radioactive de l'élément.
Période radioactive
Article détaillé : Période radioactive.On appelle « période radioactive » (ou demi-vie) T1/2 la durée au bout de laquelle le nombre de radionucléides présents dans l'échantillon est réduit de moitié. Si N(t) représente le nombre de radionucléide à un instant t, alors :
On en déduit immédiatement :
ou encore:
Où N0 est le nombre de noyaux initiaux, et λ est la constante radioactive correspondant au type de noyaux.
- Vie moyenne
Il ne faut pas confondre la demi-vie avec la vie moyenne t. Celle-ci s'obtient par le raisonnement suivant : La quantité de noyaux qui se désintègrent à l'instant t a « vécu » pendant cette durée t ou, plus exactement, à l'instant t il reste N0 exp(–λ t) noyaux présents. De ceux-ci, pendant une durée dt, il s'en détruit
dN = λ N0 exp(–λ t) dt.
Ces dN ont donc une durée de vie comprise entre t et t + dt. On peut donc définir la durée moyenne de vie pour l'ensemble des radionucléides de l'échantillon (ou simplement vie moyenne) par
t = ∫N0→0 t dN / N0.
En tenant compte de l'expression de dN donnée ci-dessus, on obtient donc [1]
t = λ ∫0→∞ t exp(–λ t) dt = λ–1 ≅ 2,718 T1/2.
Dans la littérature scientifique, on désigne généralement la durée de vie radioactive moyenne par la lettre grecque τ, donc
τ = t = λ–1. Cette durée de vie ne dépend pas de la taille de l'échantillon N0 ; c'est un temps caractéristique du radionucléide considéré, tout comme sa période T1/2. Au bout de ce temps caractéristique τ, l'activité est réduite à la fraction 1/e de sa valeur initiale :
N(τ) = N0 exp(–λ/λ) = N0/e.
Activité moyenne
Activité d'un élément
On appelle « activité » le nombre de désintégrations par seconde d'un échantillon composé de N noyaux radioactifs. L'activité moyenne, notée A est exprimée en becquerel (Bq), qui représente le taux de désintégration des noyaux (nombre de désintégrations par secondes). On note:
Où:
- n est le nombre de noyaux qui se sont désintégrés durant une période Δt
- ΔN la variation du nombre de noyaux non désintégrés, qui sera fatalement négative pour une durée positive (Car les noyaux se désintègrent et donc leur nombre diminue).
En différenciant, on a immédiatement:
- A = N0.λ.e − λ.t
En remplaçant la constance radioactive λ par sa valeur exprimée en demi-vie, on voit que l'activité est inversement proportionnelle à la demi-vie de l'élément:
Le becquerel est une unité très petite. Quand un élément radioactif est présent en quantité métriques, le nombre d'atomes impliqués est de l'ordre du nombre d'Avogadro, soit 6x10^23. Pour un élément dont la demi-vie est d'un million d'années, soit 30x10^12 secondes, une mole de matière radioactive aura une activité de l'ordre de 20x10^9 Bq.
Activité d'un mélange dans le temps
D'une manière générale, un isotope radioactif présente une activité massique d'autant plus grande que sa demi-vie est brève. Les radioactivités fortes disparaissent donc rapidement, à échelle géologique. Les matières très radioactives ne le sont que pendant un temps relativement faible, et la radioactivité de vie longue (à échelle géologique) ne peut atteindre que des niveaux de radioactivité relativement faibles.
Dans le cas d'un mélange comme les produits de fission, au bout d'un certain temps de refroidissement, la radioactivité est dominée par les radioisotopes dont la demi-vie est de l'ordre de grandeur de ce temps de refroidissement : les radioisotopes dont la demi-vie est significativement plus courte se sont désintégrés plus rapidement, et leur niveau de radioactivité résiduel est négligeable ; et ceux dont la demi-vie est significativement plus longue sont moins radioactifs, et leur niveau de radioactivité est noyé par celui des éléments plus actifs.
Ainsi, dans le cas des produits de fission qui forment la majeure partie des déchets HAVL :
- Au bout d'une trentaine d'années, la radioactivité dominante est celle du césium 137 (30 ans) et du strontium 90 (28,8 ans), qui ont une activité massique de l'ordre de 3,3 et 5,2 TBq/g respectivement. Comme ces deux éléments représentent de l'ordre de 10% des produits de fission, les produits de fission ont alors une activité massique globale de l'ordre de quelques centaines de GBq/g.
- Au bout de quelques dix mille ans, la radioactivité dominante est celle du technétium 99 (211 000 ans), qui représente de l'ordre de 5% des produits de fissions. Son activité massique étant de 630 MBq/g, l'activité massique des produits de fissions est alors de l'ordre de 31 MBq/g.
- Comme aucun produit de fission n'a de durée de vie comprise entre cent et dix mille ans, l'activité du Technétium est celle des produits de fission pendant tout cet intervalle de temps.
Filiation de deux isotopes dépendants
- Cas général
Décroissance radioactive de deux corps, cas général (échelle logarithmique)
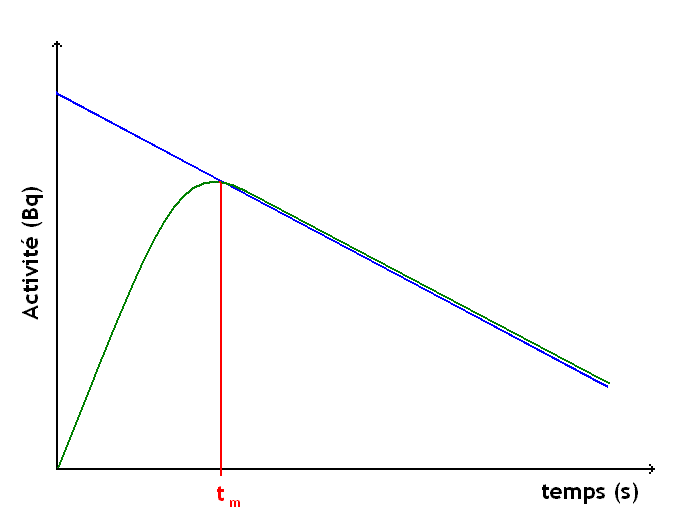
Soit l'isotope 1 qui se transforme en isotope 2 selon une constante radioactive λ1. L'isotope 2 décroît selon la constante radioactive λ2.
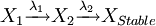
La décroissance de l'isotope 1 n'est pas influencée par l'isotope 2. Par contre, la quantité d'isotope 2 au temps t dépend de la quantité d'isotope 1 à l'origine et des deux constantes radioactives λ1 et λ2.
On a donc : dN1 = − λ1N1dt et dN2 = λ1N1dt − λ2N2dt
Ainsi, pour atteindre un éventuel équilibre entre les activités des deux isotopes, il faut une durée :
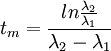
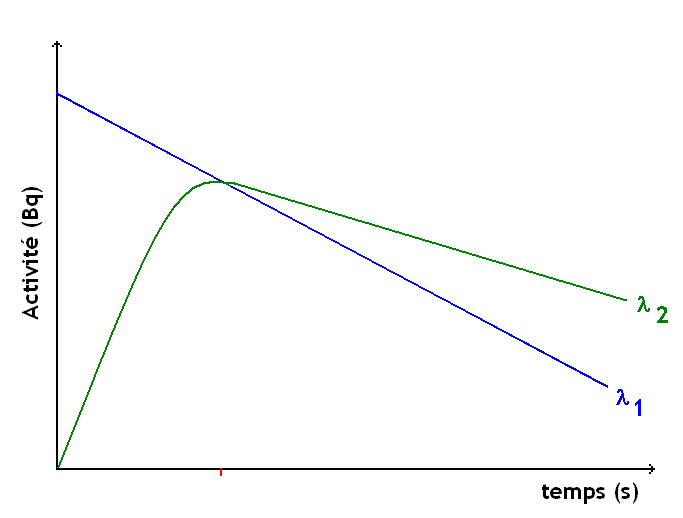
- La période de l'isotope 1 est inférieure à la période de l'isotope 2
Décroissance radioactive de deux corps, cas où T1<T2 (échelle logarithmique)
Quand t > > 10T1, alors
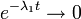
Au bout d'une durée équivalente à au moins 10 fois la période de l'isotope 1, la décroissance de l'isotope 2 ne dépend plus de l'isotope 1.
- La période de l'isotope 1 est supérieure à la période de l'isotope 2
.
Au bout d'un certain temps, un équilibre de régime est obtenu, tel que :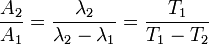
- La période de l'isotope 1 est très supérieure à la période de l'isotope 2
Un équilibre séculaire est observé au bout d'environ 10 fois la période de l'isotope 1.
Les activités des deux isotopes sont alors équivalentes et décroissent selon la constante radioactive de l'isotope 1.
Exemple : Décroissance du plutonium 240
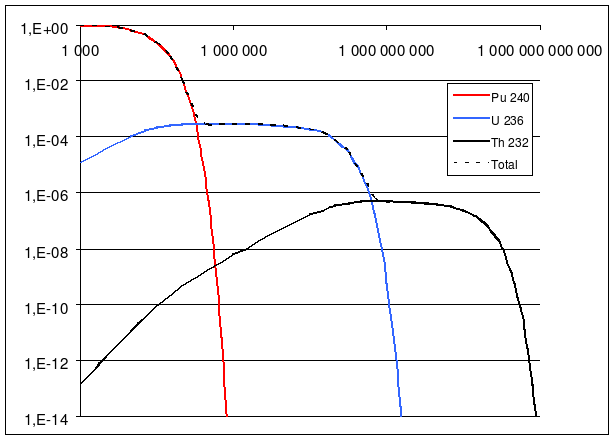
Le Plutonium 240 (période 6560 ans) se désintègre en Uranium 236 (23,42×10^6 ans), lequel se désintègre à son tour en Thorium 232 pratiquement stable (14,05×10^9 ans). Quand on représente la radioactivité de ces trois corps en fonction du temps, sur un diagramme log/log, on distingue bien trois zones distinctes:
- Le temps du plutonium: Tant que l'on ne dépasse pas la demi-vie du plutonium 240, la radioactivité du plutonium reste sensiblement constante. Pendant ce temps, la radioactivité de l'uranium 236 croît linéairement en fonction du temps (la pente de la courbe est de 1), et le thorium 232 croît comme le carré du temps (la pente de la courbe est de 2). Quand on arrive autour de la demi-vie du plutonium (entre 10 000 et 100 000 ans), son taux de radioactivité baisse significativement, et devient inférieur à celui de l'Uranium 236.
- Le temps de l'uranium: entre la demi-vie du plutonium et celle de l'uranium, la radioactivité reste sensiblement constante, mais c'est celle de l'uranium qui domine à présent. Pendant ce temps, la radioactivité du plutonium 240 perd plusieurs ordres de grandeurs, et devient globalement négligeable devant le reste. La radioactivité du thorium 232 continue à croître, mais sa croissance n'est à présent que linéaire (parce que la quantité d'uranium n'augmente plus). Quand on atteint la demi-vie de l'uranium 236 (100 à 1000 millions d'années), le taux de radioactivité de l'uranium 236 devient inférieur à celui du Thorium 232.
- Le temps du Thorium : après un milliard d'années, c'est la radioactivité du thorium qui est dominante, et celle de ses précurseurs devient négligeable. Le Thorium devient lui-même négligeable après sa demi-vie, soit de l'ordre de mille milliards d'années.
Par rapport à l'univers, nous sommes actuellement à l'âge du thorium. La terre s'est formée il y a un peu plus de quatre milliards d'années, et le Big Bang ne date « que » de 13 milliards d'années: Le plutonium et l'uranium qui avaient pu se former dans les étoiles de première génération ont disparu depuis longtemps, mais le thorium originel subsiste encore en quantités appréciables.
Filiations de n isotopes dépendants
- Soit une filiation de n isotopes :
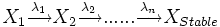
L'activité du ennième isotope peut être calculé d'après les équations de Bateman et à partir de la quantité d'isotope 1 au départ (N1)
Dans le cas particulier où le premier isotope aurait une période (T1) très longue par rapport à celles des isotopes-fils, au bout de dix fois (T1), un équilibre séculaire s'installe et tous les isotopes ont la même activité. A1 = A2 = A3 = ... = An
cet équilibre n'est réalisé que si les différents isotopes de la chaine restent piégés.- Exemple
Un exemple particulier est celui des trois chaines radioactives présentes naturellement dans l'écorce terrestre et dont les isotope pères sont : l'uranium 238, le thorium 232 et l'uranium 235.
Références
- ↑ En effet, intégrons ∫0→∞ t exp(–λ t) dt par parties en posant u = t, dv = exp(–λ t) dt, du = dt, v = – λ–1 exp(–λ t) : ∫0→∞ t exp(–λ t) dt = [– λ–1 t exp(–λ t)]0→∞ + λ–1 ∫0→∞ exp(–λ t) dt = λ–1 [– t exp(–λ t)]0→∞ – λ–2 [exp(–λ t)]0→∞ = + λ–2 puisque limt=∞ = 0. D'où le résultat annoncé : t = λ–1.
Voir aussi
Articles connexes
Lien externe
- Portail de la physique
Catégorie : Physique nucléaire
Wikimedia Foundation. 2010.