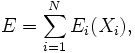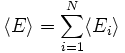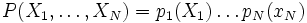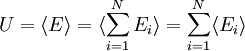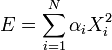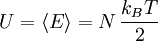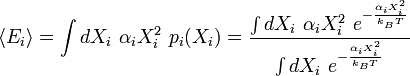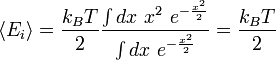- Degre de liberte (physique et chimie)
-
Degré de liberté (physique et chimie)
 Pour les articles homonymes, voir Degré de liberté.
Pour les articles homonymes, voir Degré de liberté.L'expression degré de liberté recouvre la notion indiquant la possibilité pour un système d'évoluer dans une direction non contrainte (en fonction donc d'un paramètre), et implique par conséquent la possibilité de dénombrer ces paramètres. Cette notion est utilisée en chimie, mathématiques et physique.
Sommaire
En mécanique
La notion de degré de liberté est couramment employée, et tout particulièrement en mécanique. Elle recouvre deux considérations :
- pour chaque particule appartenant à un système, et pour chaque direction indépendante dans laquelle un mouvement est possible, deux degrés de liberté sont définis, l'un décrivant la quantité de mouvement dans la direction, l'autre décrivant la position de la particule le long d'un axe défini dans cette direction.
- en ingénierie mécanique, les degrés de liberté indiquent les différentes possibilités de mouvement dans l'espace. Se référer à l'article degré de liberté (mécanique). Cette utilisation de l'expression est similaire à celle utilisée dans la typologie des vibrations moléculaires.
Dans le dernier cadre évoqué (description des mouvements moléculaires), deux types de degrés de liberté sont identifiés : les degrés de liberté externes au nombre de 6, correspondant aux mouvements de la molécule dans l'espace (translations et rotations), et les degrés de liberté internes, correspondant aux déformations de la molécule par rapport à sa conformation d'équilibre.
En mécanique et thermodynamique statistiques
En mécanique statistique, un degré de liberté est un nombre scalaire singulier décrivant le micro-état d'un système. Ce micro-état est complètement décrit par l'ensemble des valeurs de tous ses degrés de liberté.
Si le système étudié peut être décrit comme un ensemble de particules mécaniques, les degrés de liberté sont alors définis de la même manière qu'en mécanique. Ainsi, un micro-état du système est un point de l'espace des phases.
On doit noter que pour un système, un micro-état défini en utilisant des degrés de liberté est de manière intrinsèque un état classique, ceci en raison de la violation du principe d'incertitude d'Heisenberg qu'entrainerait une définition simultanée précise de la position et de la quantité de mouvement. La description d'un système par un ensemble de degrés de liberté est donc ainsi valide dans la limite classique (ou de haute température) de la mécanique statistique.
Dans certains cas, lorsque le système n'est pas décrit de manière appropriée par un ensemble de particules mécaniques, d'autres types de degrés de liberté doivent être définis. Par exemple, dans le modèle de chaine idéale tridimensionnel, deux angles sont nécessaires pour décrire l'orientation de chaque monomère. La valeur de chacun de ces angles peut être un degré de liberté.Exemple du gaz diatomique classique idéal
En trois dimensions, il existe 6 degrés de liberté associés au mouvement d'une particule, 3 pour sa position, 3 pour sa quantité de mouvement. Il existe donc 6 degrés de liberté au total. Une autre façon de justifier ce schéma est de considérer que le mouvement de la molécule sera décrit par le mouvement de deux particules mécaniques représentant ses deux atomes, que 6 degrés de liberté sont attachés à chaque particule, comme ci-dessus. Avec cette autre considération, il apparaît que différents ensembles de degrés de liberté peuvent être définis afin de définir le mouvement de la molécule. En fait les degrés de liberté pour un système mécanique est un ensemble d'axes indépendants dans l'espace des phases du système, ce qui permet de le générer entièrement. Pour un espace multidimensionnel comme l'espace des phases, il existe plus d'un ensemble possible d'axes. Il est établi que tous les degrés de liberté de la molécule d'hydrogène ne participent pas à l'expression de son énergie. Par exemple, les degrés associés à la position du centre de masse n'y participe pas.
Dans le tableau ci-dessous, les degrés négligés le sont en raison de leur faible influence sur l'énergie totale, à moins d'être à très hautes températures ou énergies. La rotation diatomique est négligée en raison de la rotation autour des axes moléculaires. La rotation monoatomique est négligée pour la même raison que la diatomique, mais cet effet est valable dans les deux autres directions.Monoatomique Molécules linéaires Molécules non-linéaires Position (x, y et z) 3 3 3 Rotation (x, y et z) 0 2 3 Vibration 0 3N - 5 3N - 6 Total 3 3N 3N Degrés de liberté indépendants
Définition
L'ensemble de degrés de liberté
 d'un système est indépendant si l'énergie associée avec l'ensemble peut être écrite sous la forme suivante :
d'un système est indépendant si l'énergie associée avec l'ensemble peut être écrite sous la forme suivante :où Ei est une fonction de la seule variable Xi.
Exemple : si X1 et X2 sont deux degrés de liberté, et E est l'énergie associée :- si
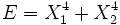 , alors les deux degrés de liberté sont indépendants.
, alors les deux degrés de liberté sont indépendants. - si
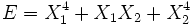 , les deux degrés de liberté ne sont pas indépendants. Le terme impliquant le produit de X1 et X2 est un terme de couplage, qui décrit une interaction entre deux degrés de liberté.
, les deux degrés de liberté ne sont pas indépendants. Le terme impliquant le produit de X1 et X2 est un terme de couplage, qui décrit une interaction entre deux degrés de liberté.
Propriétés
Si
 est un ensemble de degrés de liberté indépendants alors, à l'équilibre thermodynamique,
est un ensemble de degrés de liberté indépendants alors, à l'équilibre thermodynamique, 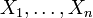 sont statistiquement indépendants les uns des autres.
sont statistiquement indépendants les uns des autres.
Pour i de 1 à N, la valeur du ie degré de liberté Xi est distribué selon une loi de Boltzmann. Sa fonction de densité de probabilité est la suivante :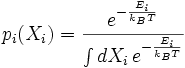 ,
,
Dans cette section, et par la suite, les
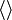 indiquent la moyenne de la quantité qu'ils entourent.
indiquent la moyenne de la quantité qu'ils entourent.
L'énergie interne du système est la somme des énergies moyennes associées à chacun des degrés de liberté :Démonstrations
On postulera par la suite que les échanges d'énergie du système considéré se font avec l'extérieur, et que le nombre de particules du système est constant, c'est-à-dire que l'on se place dans l'ensemble canonique. Rappelons qu'en physique statistique, un résultat qui est démontré pour un système reste vrai pour ce système à la limite thermodynamique dans n'importe quel ensemble. Dans l'ensemble canonique, à l'équilibre thermodynamique, l'état du système est distribué parmi les micro-états selon une distribution de Boltzmann. Si T est la température du système et kB la constante de Boltzmann, alors la fonction de densité de probabilité associée à chaque micro-état est la suivante :
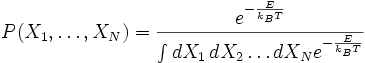 ,
,
Cette expression se transforme en un produit de termes dépendant d'un simple degré de liberté :
L'existence d'un tel développement de la fonction de densité de probabilité en un produit de fonction d'une seule variable suffit à lui seul à démontrer que les
 sont indépendants statistiquement les uns des autres.
sont indépendants statistiquement les uns des autres.
Chaque fonction pi étant normalisée, il s'ensuit que pi est la fonction de densité de probabilité du degré de liberté Xi, pour i de 1 à N.
Enfin, l'énergie interne du système est l'énergie moyenne. L'énergie Ei d'un degré de liberté est une fonction de la seule variable Xi. Puisque sont statistiquement indépendantes les uns des autres, les énergies
sont statistiquement indépendantes les uns des autres, les énergies 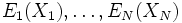 le sont aussi. L'énergie interne totale du système peut être alors écrite comme :
le sont aussi. L'énergie interne totale du système peut être alors écrite comme :Degrés de liberté quadratiques
Un degré de liberté Xi est quadratique si les termes d'énergie associés peuvent être écrits :
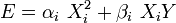 ,
,
où Y est une combinaison linéaire d'autres degrés de liberté quadratiques.
Par exemple, si X1 et X2 sont deux degrés de liberté, et E l'énergie associé :- Si
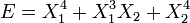 , alors les deux degrés de liberté ne sont pas indépendants et ne sont pas quadratiques.
, alors les deux degrés de liberté ne sont pas indépendants et ne sont pas quadratiques. - Si
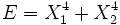 , les degrés de liberté sont indépendants et non quadratiques.
, les degrés de liberté sont indépendants et non quadratiques. - Si
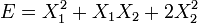 , les degrés de liberté ne sont pas indépendants et sont quadratiques.
, les degrés de liberté ne sont pas indépendants et sont quadratiques. - Si
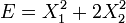 , les degrés de liberté sont indépendants et quadratiques.
, les degrés de liberté sont indépendants et quadratiques.
En mécanique
En mécanique classique, les dynamique d'un système de degrés de liberté quadratiques sont contôlées par un ensemble d'équations différentielles linéaires avec des coefficients constants.
Degrés de libertés quadratiques et indépendants
 sont des degrés de liberté quadratiques et indépendants si l'énergie associée à un micro-état du système qu'ils décrivent peut être écrite :
sont des degrés de liberté quadratiques et indépendants si l'énergie associée à un micro-état du système qu'ils décrivent peut être écrite :Théorème d'équipartition
Article détaillé : Théorème d'équipartition.En physique statistique classique, à l'équilibre thermodynamique, l'énergie interne d'un système de N degrés de liberté indépendants et quadratiques est :
Démonstration
Ici, l'énergie moyenne associée avec un degré de liberté est :
Les degrés de libertés étant indépendants, l'énergie interne du système est égale à la somme de l'énergie moyenne associée à chaque degré de liberté, ce qui démontre le résultat.
Voir aussi
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « degrees of freedom ».
- Portail de la physique
- Portail de la chimie
Catégories : Concept fondamental de la physique | Chimie générale
Wikimedia Foundation. 2010.