- Crête neurale
-
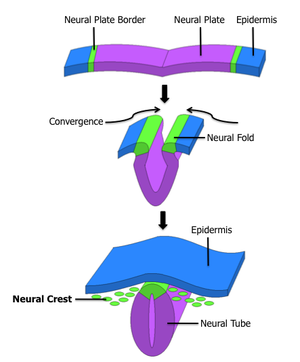 Formation de la crête neurale durant la neurulation. La crête neurale est d'abord induite sur les bords de la plaque neurale. Après la fermeture du tube neural, les cellules de la crête neurale délaminent depuis la région située entre la partie dorsale du tube et l'ectoderme sus-jacent et migrent vers la périphérie.
Formation de la crête neurale durant la neurulation. La crête neurale est d'abord induite sur les bords de la plaque neurale. Après la fermeture du tube neural, les cellules de la crête neurale délaminent depuis la région située entre la partie dorsale du tube et l'ectoderme sus-jacent et migrent vers la périphérie.
La crête neurale désigne, chez l'embryon des craniates (comprenant les notamment les vertébrés), une population de cellules transitoires et multipotentes générées à partir de la région la plus dorsale du tube neural. Ces cellules migrent dans l’ensemble de l'embryon au cours du développement et donnent naissances à une grande diversité de types cellulaires chez l'adulte. La crête neurale est à l'origine des mélanocytes (à l'exception des cellules pigmentaires de l'œil), d'une grande partie des os et des cartilages du squelette facial et du cou, de quelques cellules endocrines et donne naissance à toutes les cellules gliales et à la majeure partie des neurones du système nerveux périphérique[1].
L'apparition de la crête neurale chez les vertébrés a probablement joué un rôle clé dans leur évolution[2], leur permettant notamment de devenir prédateur (la mandibule dérive de la crête neurale) et d'accroitre la taille de leur cerveau. Celui-ci aurait pu se développer, plus facilement que chez d'autre espèce, à l’intérieur de la protection que forme les os du crâne dérivés de la crête neurale.
la crête neurale commence à se former après la gastrulation, à la frontière entre la plaque neurale et l’ectoderme adjacent. Durant la neurulation, les bords de la plaque neurale convergent au milieu de la ligne dorsale pour refermer le tube neural. Les cellules de la crête neurale, alors situées dans le toit du tube, subissent une transition d’état, passant de cellules épithéliales à mésenchymateuses et délaminent du neuroépithélium. La délamination est un processus qui consiste à la spécialisation, au détachement et à la migration d'une population de cellules présente au sein d'un épithélium auparavant homogène. Ces cellules migrent alors vers la périphérie et se différencient en divers types cellulaires en fonction de leur localisation dans l'embryon et des signaux qu'elles reçoivent[1].
Sous ce développement se cache un réseau de gènes régulateurs, comprenant des signaux moléculaires, des facteurs de transcription et des gènes effecteurs. Ce réseau de gènes régit l'ensemble des caractéristiques de ces cellules, comme leur potentiel de différentiation et leur capacité migratoire[3]. Comprendre les mécanismes moléculaires de la formation de la crête neurale est important pour mieux comprendre les pathologies liées à leur dysfonctionnement chez l’homme[1] . Les gènes impliqués dans la délamination et la migration des crêtes neurales sont fréquemment exprimés dans des tumeurs et confèrent des potentialité invasives au cellules tumorales. Dès lors, l'analyse du rôle de ces gènes chez l'embryon permet de mieux comprendre comment il influence le comportement des cellules tumorales lors d'un cancer.
Les cellules de la crête neurale sont initialement des cellules souches pluripotentes mais leurs potentialités de différenciation se restreignent au fur et à mesure de leur développement. Elles constituent un modèle de choix pour l'étude de la migration et de la différenciation cellulaire. Au cours de leur migration et de leur différentiation, elles donnent lieu à des types cellulaires intermédiaires et transitoires, comme, par exemple, les précurseurs des cellules de Schwann ou les cellules des capsules frontières. Certaines de ces cellules pourraient conserver leur caractéristique et s'établir comme cellules souches chez l'adulte.
Sommaire
Histoire
La crête neurale a été décrite pour la première fois chez l’embryon de poulet par Wilhelm His, en 1868, en tant que l’« entre-deux cordes » (Zwischenstrang), à cause de son origine située entre la plaque neurale et l’ectoderme non-neural[1]. Il appela cette structure la "crête ganglionnaire", puisqu’elle donne naissance aux ganglions spinaux sur les côtés latéraux du tube neural[4]. Durant la première moitié du 20e siècle, la majorité des recherches portant sur la crête neurale étaient faites sur des embryons d’amphibien et sont résumées dans la monographie reconnue de Hörstadius (1950)[5].
Les techniques de marquage cellulaire ont beaucoup apporté à l’étude de la crête neurale car elles permettent de suivre la migration des tissus à travers l’embryon en développement. Dans les années soixante Weston et Chibon utilisèrent un marquage avec des isotopes radioactifs du noyau avec de la thymidine tritiée chez le poulet et l’amphibien. Néanmoins la quantité de radioactivité présente dans les cellules suivies diminuait de moitié à chaque division cellulaire, ce qui rendait cette technique inutilisable sur de longues périodes. Les techniques plus modernes de marquage cellulaire, comme le rhodamine-lysine dextran ou le colorant vital diI, permettent de marquer efficacement et transitoirement les lignées cellulaires issues de la crête neurale[4].
Le système de greffe caille-poulet (quail-chick en anglais), mis au point par Nicole Le Douarin en 1969, a également beaucoup apporté à l’étude de la migration des cellules de la crête neurale[6], [7]. Cette méthode rendant possible un suivi à très long terme des cellules, elle a permis l'élucidation des dérivés de la crête neurale. Ce système consiste à implanter des cellules de caille japonaise - facilement repérables du fait de la forme particulière de leurs noyaux - chez le poulet et à suivre leur devenir dans l’embryon. Ce système crée un embryon chimérique (2 espèces présentes dans le même individu) et suppose que les cellules de la caille répondent aux même signaux que les cellules du poulet. Cette technique a permis à une large génération de scientifiques d'étudier en détail l'ontogénèse de la crête neurale.
Induction
La migration et les caractéristiques de la multipotence des cellules de la crête neurale sont régies par une cascade d’événements moléculaires. On peut subdiviser ces événements en quatre types de signalisation et de réseaux génétiques associés.
Signaux d'induction
La plaque neurale acquiert son identité par la détection de molécules de signalisation extracellulaires (notamment les molécules des familles Wnt, BMP et Fgf) qui diffusent depuis les épidermes adjacents et différencient l’ectoderme non-neural de la plaque neurale, phénomène appelé induction neurale[1],[2].
L’implication de la signalisation Wnt dans l’induction de la crête neurale a été démontrée dans de nombreuses espèces par des expériences de gain ou de perte de fonctions. En cohérence avec ces résultats, la région du promoteur du gène slug (un gène spécifique à la crête neurale) contient un site de liaison à des facteurs de transcription habituellement impliqués dans la signalisation Wnt-dépendante[8].
Les BMP (Bone Morphogenetic Proteins) sont impliquées dans l’induction de la plaque neurale, puis dans la formation de la crête neurale. Les antagonistes aux BMP génèrent un gradient de l’activité BMP dans la plaque neurale. Ainsi les cellules qui présentent un fort taux de BMP empruntent une voie de différentiation en épiderme, alors que les cellules à faible taux de BMP deviennent de la plaque neurale. Les cellules recevant un taux intermédiaire acquièrent une identité de cellule de la crête neurale[1].
Les FGF (pour Fibroblast Growth Factor) semblent être la source des signaux inducteurs spécifiques de la crête neurale[9].
Les rôles précis des BMP, FGF et Wnt dans le développement de la crête neurale sont encore mal connus et font l’œuvre d'une intense recherche.
Signaux de spécification des bords de la plaque neurale
Les événements de signalisation qui délimitent les bords de la plaque neurale induisent l’expression d’un ensemble de facteurs de transcription, qui vont établir, spécifiquement, l’identité des cellules présentes à cette frontière. Ces molécules comprennent, entre autres, les facteurs Zic, Pax3/7, Dlx5, Msx1/2 et sont des relais de l’influence des signalisations Wnt, BMP et Fgf. Ces gènes sont exprimés massivement dans la région du bord de la plaque neurale et précédent l’expression des marqueurs de la crête neurale[2].
En effet, des preuves expérimentales situent ces facteurs de transcriptions en amont des gènes spécifiques de la crête neurale. Par exemple, chez le Xenopus, MSx1 est nécessaire et suffisant pour l’expression de Slug, Snail et FoxD3[10]. De par ailleurs, Pax3 est essentiel, lui, pour l’expression de FoxD3, chez l’embryon de souris[11].
Signaux de spécification de la crête neurale
Après l’expression des gènes de spécification des bords de la plaque neurale, vient une collection de gènes de spécification de la crête neurale, dont les gènes slug/snail, foxD3, sox10, sox9, AP-2 et c-Myc. Ces gènes sont activés lorsque la crête neurale commence à émerger. Chez le Xénope et probablement chez d’autres espèces, l’expression de chacun de ces gènes est nécessaire et suffisante pour induire l’expression de tous les autres, ce qui démontre l’existence de solides mécanismes de régulation croisée[2].
En plus de ce réseau de gènes spécifiques de la crête neurale il existe deux autres facteurs de transcription impliqués au niveau de la crête neurale, Twist et Id. Twist, un facteur de transcription de la famille bHlH est requit pour la différentiation du mésenchyme des arcs pharyngés[12]. Id est une des cibles directes de c-Myc et est impliqué dans la maintenance des cellules souches de la crête neurale[13].
Gènes effecteurs
Enfin, les signaux de spécifications entrainent l’expression de gènes effecteurs, qui confèrent aux cellules de la crête neurale leurs propriétés de migration et de multipotence. Les molécules des familles Rho GTPase et des cadherines sont notamment impliquées dans la régulation de la morphologie cellulaire et dans les propriétés d’adhésion. D’autre part, Sox9 et Sox10 régulent la différentiation des cellules de la crête neurale en activant de nombreux effecteurs spécifiques des différentes populations cellulaires engendrées, comme Mitf, P0, Trp et cKit[2].
Lignées cellulaires
Les cellules de la crête neurales se différencient en différents types de tissus et de cellules en fonction de leur position le long de l’axe antéro-postérieur de l’embryon. On peut distinguer quatre domaines de différentiation : le crâne, le tronc la région sacrée et le tissu cardiaque.
Crête neurale du crâne
Au niveau du crâne, les cellules de la crête neurales migrent dorsolatéralement pour former le mésenchyme craniofacial et se différencient par la suite en ganglions, en cartilage ou en os[14]. Dans la partie rostrale, elles forment les cartilages fronto-nasaux et les os membraneux du crâne. Plus postérieurement, ces cellules entrent dans la poche pharyngée et les arcs brachiaux où elles contribuent à la formation de la mâchoire, des cartilages hyoïdien et thryroïdien, de l’oreille moyenne et forment les odontoblastes des premières dents[15],[16].
Crête neurale du tronc
Les cellules de la crête neurale du tronc donnent naissance à trois populations de cellules. Un groupe de cellules, destinées à devenir les mélanocytes de la peau, migre dorso-latéralement à travers l'ectoderme et se répartit dans tout l’embryon jusqu’à la zone ventrale. Un second groupe de cellules migre ventro-latéralement, à travers la partie antérieure de chaque sclérotome. Certaines forment les ganglions spinaux au niveau du sclérotome et d’autres, qui migrent plus ventralement, forment les ganglions sympathiques, les glandes surrénales et les nerfs entourant l’aorte, ainsi que les cellules de Schwann de l’ensemble des nerfs[16]. Enfin, une troisième population de cellules migre ventrolatéralement et se positionne au niveau des frontières entre le tube neural et la périphérie, où elles forment des structures appelées capsules frontières[17].
Crête neurale vagale et sacrée
La crête neurale au niveau vagal et sacré donne naissance aux ganglions du système nerveux entérique, aussi appelés ganglions parasympathiques[16].
Crête neurale cardiaque
La crête neurale cardiaque se développe également en mélanocytes, en cartilage, en tissu conjonctif et en neurone de certains arcs branchiaux. Par contre, de manière plus spécifique, ce domaine de la crête donne naissance à certaines parties du cœur, dont le tissu musculo-conjonctif des artères et une partie du septum qui sépare la circulation pulmonaire de l’aorte[16].
Évolution
Beaucoup des structures qui distinguent les vertébrés des autres chordés sont issues de la crête neurale. L’apparition de la crête neurale est donc une des évolutions à la base du développement des vertébrés sur Terre. Elle aurait ainsi permis le développement de la taille du cerveau grâce à la boite crânienne ou encore l’augmentation de la taille des membres par le développement d’un système nerveux périphérique. Cette évolution est également clé dans l’apparition d’un comportement de prédateur chez les vertébrés[18].
Dérivés de la crête neurale
Dérivés faisant partie du Mésectoderme:
- les odontoblastes
- la papille dentaire
- le cartilage du chondrocrâne (capsule nasale, cartilage de Meckel, osselets scléreux, l'os carré, le cartilage articulaire, l'hyoïde et la columelle), trachéal et laryngé
- le dermatocranium (os membranaire), les ailettes dorsales et la carapace des tortues (vertébrés inférieurs)
- les péricytes et les muscles lisses des artères et veines brachiales
- les tendons des muscles oculaires et masticateurs
- le tissu conjonctif des glandes de la tête et du cou (pituitaires, salivaires, lacrymales, thymus, thyroïdiennes)
- le derme et le tissu adipeux de la calvaria, de la partie ventrale du cou et de la face
Dérivés en cellules endocrines:
- cellules entérochromaffines
- cellules parafolliculaires
- cellules secrétrices de calcitonine
- corps carotidiens, type I/II
- cellules de la glande surrénale
Dérivés formant le Système nerveux périphérique:
- Neurones sensoriels et glie des ganglions spinaux et céphaliques (VII et en partie, III, V, IX, et X),
- Cellules des capsules frontières
- Cellules de Rohon-Beard
- Cellules de Merkel
- cellules satellites (gliales) de tous les ganglions autonomes et sensitifs
- Cellules de Schwann de tous les nerfs périphériques.
Enfin elles forment également les mélanocytes et les cellules de pigmentation de l’iris, les méninges et participent aux cloisonnement du coeur.
Voir aussi
Références
- Huang, X., and Saint-Jeannet, J.P. (2004). Induction of the neural crest and the opportunities of life on the edge. Dev. Biol. 275, 1-11.DOI:10.1016/j.ydbio.2004.07.033
- Meulemans, D., and Bronner-Fraser, M. (2004). Gene-regulatory interactions in neural crest evolution and development. Dev Cell. 7, 291-9.DOI:10.1016/j.devcel.2004.08.007
- Sauka-Spengler, T., Meulemans, D., Jones, M., and Bronner-Fraser, M. (2007). Ancient evolutionary origin of the neural crest gene regulatory network. Dev Cell. 13, 405-20. DOI:10.1016/j.devcel.2007.08.005 PMID 17765683
- Le Douarin, N.M. (2004). The avian embryo as a model to study the development of the neural crest: a long and still ongoing story. Mech Dev. 121, 1089-102. DOI:10.1016/j.mod.2004.06.003
- Hörstadius, S. (1950). The Neural Crest: Its Properties and Derivatives in the Light of Experimental Research. Oxford University Press, London, 111 p.
- Le Douarin, N.M. (1969). "Particularités du noyau interphasique chez la Caille japonaise (Coturnix coturnix japonica). Utilisation de ces particularités comme «marquage biologique» dans les recherches sur les interactions tissulaires et les migrations cellulaires au cours de l'ontogenèse". Bull biol Fr Belg 103 : 435-52.
- Le Douarin, N.M. (1973). "A biological cell labeling technique and its use in experimental embryology". Dev Biol. 30 217-22. DOI:10.1016/0012-1606(73)90061-4
- Vallin, J. et al. (2001). "Cloning and characterization of the three Xenopus slug promoters reveal direct regulation by Lef/beta-catenin signaling". J Biol Chem. 276, 30350-8. DOI:10.1074/jbc.M103167200
- Mayor, R., Guerrero, N., Martinez, C. (1997). "Role of FGF and noggin in neural crest induction". Dev Biol. 189 1-12. DOI:10.1006/dbio.1997.8634
- Tribulo, C. et al. (2003). "Regulation of Msx genes by Bmp gradient is essential for neural crest specification". Development. 130, 6441-52.DOI:10.1242/dev.00878
- Dottori, M., Gross, M.K., Labosky, P., and Goulding, M. (2001). "The winged-helix transcription factor Foxd3 suppresses interneuron differentiation and promotes neural crest cell fate". Development 128, 4127–4138.
- Vincentz, J.W. et al. (2008). "An absence of Twist1 results in aberrant cardiac neural crest morphogenesis". Dev Biol. 320, 131-9. DOI:10.1016/j.ydbio.2008.04.037
- Light, W. et al. (2005). "Xenopus Id3 is required downstream of Myc for the formation of multipotent neural crest progenitor cells". Development. 132, 1831-41. doi: 10.1242/dev.01734
- Taneyhill, L.A. (2008). "To adhere or not to adhere: the role of Cadherins in neural crest development". Cell Adh Migr. 2, 223-30.
- Minoux M., Rijli F.M. (2010). "Molecular mechanisms of cranial neural crest cell migration and patterning in craniofacial development". Developement
- http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=dbio&part=A3109#A3133
- Piotr Topilko, « Les cellules des capsules frontières — Une niche de cellules souches neurales dans le système nerveux périphérique », dans Bull. Acad. Natle Méd., vol. 191, no 7, 2007, p. 1383-1394 (ISSN 00014079)
- Gans, C. and Northcutt, R. G. (1983). "Neural crest and the origin of vertebrates: A new head". Science 220, 268–274. DOI:10.1126/science.220.4594.268
Lien externe
Wikimedia Foundation. 2010.
