- Condensation - dynamique des aerosols
-
Condensation - dynamique des aérosols
La condensation, dans le cas des aérosols, se produit lorsque de la vapeur se condense sur une particule, ou s’en évapore. Le phénomène de la condensation peut être résumé par la transition de phase de gazeux à liquide lorsque la vapeur se condense sur la particule, ou, dans le cas de l’évaporation, de liquide vers gazeux. Lorsque la vapeur se condense, la particule hôte grossit alors que dans le cas de l’évaporation, elle rapetisse. Cet effet est relié à la distribution de la taille des aérosols. Si le bilan est positif, on a condensation et donc la distribution des tailles tend vers les plus grosses tailles. Si le bilan est négatif, on a évaporation et la distribution des tailles tend vers les plus petites tailles. Si les particules sont plus grosses, la concentration massique dans l’air augmente. Le contraire se produit lorsque les particules rapetissent.
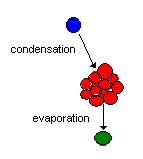 condensation et evaporation
condensation et evaporation
Les conditions ambiantes telles que la pression de vapeur et la température autour de la particule decide à savoir s’il y aura condensation ou évaporation. À partir de l’effet de Kelvin (basé sur le fait que les gouttelettes sont courbes et non plates telles les surfaces liquides habituelles) on déduit que les plus petites gouttelettes demandent une humidité relative supérieure à celle que demandent les plus grosses gouttelettes pour se maintenir à l’équilibre. L’humidité relative (exprimée en %) pour les conditions d’équilibre s’exprime de la façon suivante :
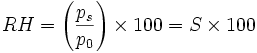 où ps est la pression de vapeur de saturation au dessus d’une particule à l’équilibre (autour d’une surface courbe), p0 est la pression de vapeur de saturation pour une surface plane pour le même liquide et S est le rapport de saturation.
où ps est la pression de vapeur de saturation au dessus d’une particule à l’équilibre (autour d’une surface courbe), p0 est la pression de vapeur de saturation pour une surface plane pour le même liquide et S est le rapport de saturation.L’équation de Kelvin pour la pression de vapeur de saturation autour d’une surface courbe est :
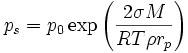
où p0 est la pression de vapeur de saturation pour une surface plane, rp est le rayon de la gouttelette, σ est la tension de surface de la gouttelette, ρ est la densité du liquide, M est la masse molaire, T est la température, et R est la constante des gaz parfaits.
- Portail de la physique
Catégorie : Thermodynamique
Wikimedia Foundation. 2010.
