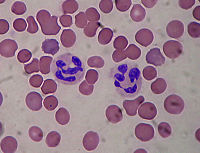
- Coloration de May-Grünwald-Giemsa
-
May-Grünwald Giemsa
La coloration de May-Grünwald Giemsa est une méthode de coloration utilisée en hématologie pour différencier les cellules du sang lors des préparations cellulaires (cytologie). Les colorations de May-GrÜnwald, Giemsa, Leishmann sont des variétés de la méthode de Romanowsky (médecin russe, 1861-1921).
Sommaire
Principe de la coloration
Il repose sur l'action complémentaire de deux colorants neutres et sur l'affinité des éléments cellulaires pour les colorants acides ou basiques. Ces deux colorants sont :
- Le May-Grünwald, neutre, contenant un colorant acide, l'éosine , et un colorant basique, le bleu de méthylène (sous forme d'éosinate de bleu de méthylène).
- Le Giemsa, neutre, contenant lui aussi de l'éosine , et un colorant basique, l'azur de méthylène (sous forme d'éosinate d'azur de méthylène)
Ces deux colorants sont solubilisés dans l'alcool méthylique et sont de ce fait inactifs : c'est le contact de l'eau qui leur donne un pouvoir colorant. Les sels se dissocient alors en colorant acide (l'éosine) et basique (azur et bleu de méthylène).
- Les éléments cellulaires acides, seront colorés sélectivement par les colorants basiques. Ces éléments sont qualifiés de basophiles (ADN, cytoplasme des lymphocytes)
- Les éléments cellulaires basiques, seront colorés sélectivement par les colorants acides. Ces éléments sont qualifiés d'acidophiles ou d'éosinophiles ( cytoplasme des hématies)
- Les éléments neutrophiles sont colorés à la fois par les colorants acides et basiques.
Elle colore en :
- bleu, les résidus basophiles
- orange, les résidus éosinophiles
- beige-rose, les résidus neutrophiles
- pourpre, les résidus azurophiles
Particularités
Les colorations sont orthochromatiques: les éléments colorés ne changent pas de conformation et prennent la même teinte que celle du colorant. Il existe cependant un cas particulier : les éléments azurophiles, fixant l'azur de méthylène bleu deviennent rouge à cause d'un changement de conformation.
L'eau utilisée pour activer les colorants et rincer les lames doit être le plus proche possible de la neutralité ( pH compris entre 6.8 et 7.4) pour ne pas accentuer les colorations (un pH basique accentue le bleu de méthylène aux dépens de l'éosine, et inversement). Pour obtenir de l'eau dans ces valeurs de pH on peut- utiliser une eau tamponnée à pH 7 avec un mélange d'hydrogénophosphate et de dihydrogénophosphate
- Mélanger de l'eau distillée ( acide) avec de l'eau du robinet ( basique) en présence de BBT.
Dans tous les cas cette eau ne se conserve pas et doit être préparée au dernier moment.
Technique
Fixation
Il faut d'abord fixer les cellules sanguines présentes sur le frottis. Pour cela placer le frottis horizontalement dans une boîte de coloration et verser 15 à 20 gouttes de colorant May-Grünwald de façon à recouvrir totalement le frottis. Attendre 3 minutes pour que le méthanol fixe les cellules.
Coloration May-Grünwald
Ajouter autant d'eau qu'il y a eu de colorant, laisser agir deux minutes et rincer la lame.
Coloration au Giemsa
Préparer le colorant en mettant 20 ml d'eau neutre avec 30 gouttes de colorant dans une burette. Le colorant doit rester en surface. Verser le contenu dans une boîte de Laveran dès que la lame est prête et mélanger en agitant doucement (le pouvoir du colorant est maximal au moment du mélange). Poser la lame, frottis en contact avec le colorant, dans la boîte de Laveran. Laisser agir 20 min. et rincer à l'eau neutre.
Séchage
Laisser la lame sécher à l'air après l'avoir essuyée avec du papier filtre. Attendre le séchage complet avant observation au microscope.
Observation
Granulocyte neutrophile Granulocyte éosinophile Granulocyte basophile 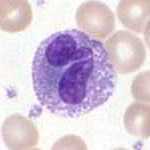 Un polynucléaire éosinophile (x 100)
Un polynucléaire éosinophile (x 100)
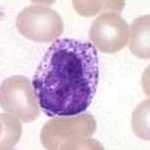 Granulocyte basophile
Granulocyte basophile
Voir aussi
D'autres techniques de coloration :
- coloration de Papanicolaou de Georgios Papanicolaou.
Vidéo
- Portail de la médecine
Catégories : Biologie médicale | Hémogramme | Technique de laboratoire
Wikimedia Foundation. 2010.