- Chiffres significatifs
-
Chiffre significatif
Dans une mesure physique, le nombre de chiffres significatifs détermine la précision de la mesure. Il s'agit des chiffres connus avec certitude plus le premier chiffre incertain.
Par exemple: 1234 a 4 chiffres significatifs. Le premier chiffre incertain est le 4.
Cas du 0
- Lorsque le 0 est placé à gauche, il n'est pas significatif:
0,8 a 1 chiffre significatif
0,0052 a 2 chiffres significatifs
031 a 2 chiffres significatifs- Lorsque 0 est placé entre deux chiffres significatifs non nuls, il est significatif:
1203 a 4 chiffres significatifs
12,03 a 4 chiffres significatifs
120,4 a 4 chiffres significatifs- Lorsque le 0 est placé à droite, mais après la virgule, il est significatif:
1,200 a 4 chiffres significatifs
0,0520 a 3 chiffres significatifs- Le cas des nombres entiers tels: 400, 1000, 10... est ambigu.
Par exemple 400 peut s'écrire de diverses façons:
400 avec 3 chiffres significatifs
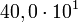 avec 3 chiffres significatifs
avec 3 chiffres significatifs
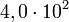 avec 2 chiffres significatifs
avec 2 chiffres significatifs
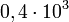 avec 1 seul chiffre significatif
avec 1 seul chiffre significatif
Selon la façon dont il est écrit, le nombre de chiffres significatifs varie. Il est donc préférable d'écrire de tels nombres en notation scientifique.En notation scientifique, tous les chiffres de la mantisse sont significatifs.
Convention
On rencontre fréquemment dans les tables des valeurs telles:
12,43
Avec 4 chiffres significatifs.
Par convention il s'agit d'une valeur abrégée pour:
12,43 +/- 0,01
Sommaire
Chiffres significatifs et opérations
Lors d'un calcul, les données sont parfois fournies avec des nombres de chiffres significatifs différents. Le résultat du calcul doit alors être exprimé avec le nombre de chiffres significatifs de la donnée qui en possède le moins.
Addition et soustraction
Après une addition ou une soustraction, le résultat ne doit pas avoir plus de décimales que le nombre qui en comporte le moins.
Exemple 1
On calcule la masse molaire du thiosulfate de sodium pentahydraté Na2S2O3 , 5H2O :
M(Na) = 23,0 g.mol−1
M(O) = 16,0 g.mol−1
M(S) = 32,05 g.mol−1
M(H) = 1,008 g.mol−1
M(Na2S2O3 , 5H2O) = 248,2 g.mol−1 (M(Na) et M(O) n'ont qu'une décimale)Exemple 2
Simplifier : Périmètre du rectangle: L= 143 cm (donc 3 chiffres significatifs et pas de décimale) et l= 5,7 cm (donc 2 chiffres significatifs et une décimale)
P= 2x(5,7+143) P= 2x148.7 P= 297.4
Mais 143 n'ayant pas de décimale, le périmètre ne doit pas en avoir non plus donc: P= 297 cm
Multiplication et division
Après une multiplication ou une division, le résultat ne doit pas avoir plus de chiffres significatifs que la valeur la moins précise.
Exemple
On dissout une masse m = 6,17 g de thiosulfate de sodium pentahydraté M = 248,2 g.mol−1 dans un volume V = 150,0 mL de solution, la concentration molaire apportée est :
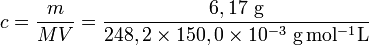
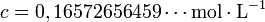 résultat brut, incorrect.
résultat brut, incorrect.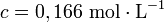 résultat correct avec 3 chiffres significatifs
résultat correct avec 3 chiffres significatifsles logarithmes
Les logarithmes ont le même nombre de chiffres significatifs que leur argument. Cette règle amène à des subtilités avec le logarithme décimal.
les nombres: 4,2 102 et 4,2 103 sont tous deux donnés avec 2 chiffres significatifs.
Leurs logarithmes décimaux donnent respectivement:
2,6232.... 3,6232...
On constate donc que le nombre avant la virgule n'est que la valeur de l'exposant. Cette valeur ne servant qu'à positionner la virgule, elle n'est pas elle-même un chiffre significatif. Par conséquent le logarithme de nos deux nombres avec 2 chiffres significatifs doit s'écrire:
2,62
Articles connexes
Notes et références
Catégories : Métrologie | Numération
Wikimedia Foundation. 2010.
