- 7790-93-4
-
Acide chlorique
Acide chlorique 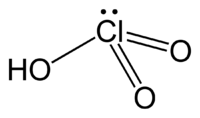
Général Nom IUPAC acide chlorique No CAS Apparence solution incolore Propriétés chimiques Formule brute HClO3 [Isomères] Masse molaire 84,459 g∙mol-1
H 1,19 %, Cl 41,98 %, O 56,83 %,Propriétés physiques Solubilité >40 g/100 ml (eau,20 °C) Précautions Directive 67/548/EEC 
C
OPhrases R : 8, 34, Phrases S : 17, 26, 36/37/39, 45, Unités du SI & CNTP, sauf indication contraire. L'acide chlorique est un acide qui a pour formule HClO3 et dont la base conjuguée est l'ion chlorate ClO3−.
Sommaire
Description
L'acide chlorique est l'oxacide à base de chlore V. C'est un acide fort et un oxydant puissant comme ses sels les chlorates. En milieu basique il est thermodynamiquement instable face à sa dismutation en ion chlorure et perchlorate suivant la réaction 4 ClO3- → 3 ClO4- + Cl- mais cette réaction est lente. En présence de réducteurs il peut donner des vapeurs toxiques de ClO2.
Synthèse
On peut préparer des ions chlorates par dismutation d'ions hypochlorite suivant la réaction : 3 ClO- → ClO3- + 2 Cl-.
Utilisations
On utilise surtout des sels d'ions chlorate.
- Le chlorate de potassium est utilisé comme désherbant total en particulier pour obtenir des allées de terre sans aucune herbe. Néanmoins, en raison de son caractère fortement oxydant, il n'est vendu de nos jours qu'en petites quantités et mélangé à d'autres produits. Il sert aussi de transporteur d'oxygène dans les allumettes et les dispositifs pyrotechniques.
- Le « chlorate de soude » ou chlorate de sodium est utilisé principalement pour la génération du dioxyde de chlore (oxydant puissant utilisé pour le blanchiment de la pâte à papier et comme désherbant domestique). Ajoutés au chlorate de sodium, les sels de vanadium renforcent son action herbicide, alors qu'ils sont aussi utilisés en agriculture comme oligo-éléments fertilisants.
- Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique comburant | Oxoacide | Composé du chlore
Wikimedia Foundation. 2010.
