- Équation de Henderson-Hasselbach
-
Équation de Henderson-Hasselbalch
En chimie, l'équation de Henderson-Hasselbalch (également appelée équation de Henderson-Hasselbach) est une équation donnant le pH d'un système tamponné. Elle est utilisée dans le domaine de la médecine pour déterminer le pH sanguin à partir des concentrations en ion bicarbonate et en acide carbonique.
Sommaire
Formulation de l'équation
L'équation peut être obtenue à partir de la constande de dissociation Ka d'un acide HA[1].
![\mathrm{K_a = \frac{[H_3O^+][A^-]}{[HA]}}](/pictures/frwiki/97/a20d15bb7644196df2d51f0b016d0acd.png)
En prenant le logarithme de chaque coté :
![\mathrm{\log{K_a} = \log{[H_3O^+]} + \log{\frac{[A^-]}{[HA]}}}](/pictures/frwiki/54/6d4fa53b1514bc6a0beda6456a3a40c9.png)
En déplaçant les termes, et par définition du pKa et du pH, on obtient l'équation de Henderson-Hasselbalch :
![\mathrm{pH = pK_a + \log{\frac{[A^-]}{[HA]}}}](/pictures/frwiki/55/7f69457a714b82695896062adb6a452f.png)
Cette équation exprime le pH du système en fonction du pKa du couple acide-base considéré, et des concentrations respectives en l'acide (HA) et en la base conjuguée (A-).
On remarque que lorsque les concentrations en l'acide et en la base conjuguée sont identiques, le pH du milieu est égal au pKa du couple acide/base, et on se trouve en plein mélange tampon.
Application au pH du sang
L'équation de Henderson-Hasselbach permet de calculer le pH sanguin à partir des concentrations en ion bicarbonate (
![[HCO_3^-]](/pictures/frwiki/50/244662c3f7532d55cfc7729c6d096ccf.png) ) et en acide carbonique ([H2CO3]), à partir de la réaction acido-basique réversible indiquée ci-dessous :
) et en acide carbonique ([H2CO3]), à partir de la réaction acido-basique réversible indiquée ci-dessous :
Cette réaction est fortement déplacée vers la droite et catalysée par une enzyme plasmatique, l'anhydrase carbonique.
Physiologie sanguine
Le principal système tampon acido-basique dans un organisme mammifère est représenté par le couple acide carbonique/bicarbonate indiqué ci-dessus.
On peut écrire pour celui-ci l'équation de Henderson-Hasselbalch, avec comme pKa celui de l'acide carbonique :
![pH_{sang}=6,1+\log_{10}\frac{[HCO_3^-]_{sang}}{[H_2CO_3]_{sang}}](/pictures/frwiki/52/4c3c6263f01aee67e9752a16f59e9a67.png)
En biologie médicale, l'équation de Henderson-Hasselbach est simplifiée en y intégrant la pression partielle sanguine en dioxyde de carbone (Psang(CO2)) :
![pH_{sang}=6,1+\log_{10}\frac{[HCO_3^-]_{sang}}{0,03\cdot P_{sang}(CO_2)}](/pictures/frwiki/51/3d5b85077310ea87ffe212a93aaeaa88.png)
Ainsi, le pH sanguin dépend de la bicarbonatémie (mesurée en mEq.L-1) et de la pression partielle sanguine en dioxyde de carbone (mesurée en mmHg).
Biologie médicale vétérinaire
L'équation de Hendersen-Hasselbach, très utilisée en soins intensifs et en réanimation vétérinaires, permet de corriger les déséquilibres acido-basiques.
Valeurs usuelles, en moyenne, chez le chien et le chat :Acidémie[2] Norme (sang veineux) Norme (sang artériel) Alcalémie[3] pH 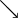
7,35 7,40 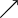
P(CO2) (mmHg) 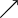
40 35 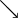
![[HCO_3^-]](/pictures/frwiki/50/244662c3f7532d55cfc7729c6d096ccf.png) (mEq.L-1)
(mEq.L-1)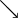
20 24 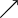
Notes et références
- ↑ Paula Yurkanis Bruice, Organic Chemistry, éd. Pearson Education, Inc., 2007, États-Unis d'Amérique, 5e éd. à la page 60 (Chapter 1. Electronic Structure and Bonding - Acids and Bases)
- ↑ pH sanguin plus bas que les valeurs usuelles
- ↑ pH sanguin plus haut que les valeurs usuelles
Articles connexes
- Portail de la biologie cellulaire et moléculaire
- Portail de la chimie
- Portail de la médecine
Catégories : Chimie des solutions | Médecine vétérinaire
Wikimedia Foundation. 2010.
