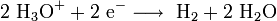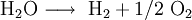- Voltametre d'Hoffmann
-
Voltamètre d'Hoffmann
Le voltamètre d'Hoffmann est un appareil pouvant réaliser l'électrolyse de l'eau et inventé par August Wilhelm von Hofmann (1818–1892). La voltamétrie -avec un seul m- permet la mesure d'une quantité d'électricité par le suivi de l'avancement d'une réaction électrochimique quantitative (c'est une coulométrie).
Sommaire
Description et principe de fonctionnement
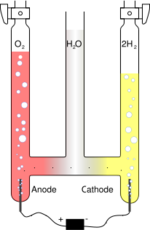
Il consiste en trois tubes joints par leurs bases, habituellement en verre. Le cylindre du milieu est ouvert à son extrémité pour permettre l'addition d'eau et d'électrolyte pouvant augmenter la réactivité (comme du sel de table ou de l'acide sulfurique). Une électrode de platine est placée au fond de chacun des deux cylindres latéraux, connectée soit au pôle positif, soit au pôle négatif de la source d'électricité (courant continu). Lorsque le courant circule dans le voltamètre d'Hoffmann, de l'oxygène gazeux (O2) se forme à l'anode, et de l'hydrogène gazeux (H2) à la cathode. Chaque gaz déplace de l'eau et peut être collecté au sommet des deux tubes latéraux.
Un test simple
La présence de gaz dans le tube collecteur peut être vérifiée par le "test de l'allumette" (ou d'un tison incandescent) : l'oxygène fera que l'allumette s'enflammera immédiatement dans une flamme blanche et brillante alors que l'hydrogène causera juste une augmentation de l'incandescence.
Précisions sur le terme voltamètre
- Le mot de voltamètre fût forgé par John Frederic Daniell, par simplification du terme "volta-electrometer" introduit par Michael Faraday"[1]. Le terme voltamètre a longtemps été utilisé mais T.W. Richards a suggéré l'utilisation plus moderne du terme "coulomètre" qui semble plus explicite, puisqu'il s'agit d'un instrument de mesure d'une quantité d'électricité [2].
- Le nom de voltamètre ne doit pas être confondu avec un voltmètre qui permet de mesurer une différence de potentiel entre deux points d'un circuit - les voltamètres, voltameter en anglais, étaient des coulomètres chimiques utilisés comme instruments de mesure d'une quantité d'électricité Q (exprimée en Coulomb) à partir de la mesure du volume de gaz produit durant une électrolyse (ou par la pesée de la masse d'un métal déposé). Cependant, avant l'invention de l'ampèremètre, les voltamètres étaient utilisés pour mesurer l'intensité du courant continu : le courant circulant dans un voltamètre avec des électrodes de fer ou de cuivre conduit, par électrodéposition, à un dépôt de métal sur la cathode dont la masse est directement proportionnelle à l'intensité du courant total (si celui-ci restait constant pendant la durée de l'électrolyse car la quantité d'électricité mesurée résulte de l'intégration de l'intensité du courant pendant la durée de l'expérience selon la loi de Faraday sur l'électrolyse).
- Il convient d'éviter la confusion entre la "voltammétrie" -avec deux m- qui donne accès à la cinétique électrochimique à partir du tracé des courbes intensité-potentiel (avec un potentiostat) et la "voltamétrie" -avec un seul m- qui consiste à mesurer une quantité d'électricité (en Coulomb) grâce à l'utilisation d'un voltamètre. Les dénominations voltammétrie et voltammogramme -avec deux m-, sont des anglicismes dérivés des termes anglais voltammetry et voltammogram (formés à partir de ammeter qui signifie ampèremètre). Les termes français synonymes sont voltampérométrie et voltampérogramme.
Principe
Un voltamètre (ou coulomètre) est une cellule d'électrolyse qui permet de mesurer la quantité d'un produit formé (ou d'un réactif disparu) pendant la durée de l'expérience. On peut distinguer, d'une part, les voltamètres destinés a mesurer les volumes de gaz formés (dioxygène et dihydrogène lors de l'électrolyse de l'eau); on parlera alors de voltamètres volumétriques. D'autre part, il existe les voltamètres destinés a mesurer la variation de masse d'une cathode sur laquelle une électrodéposition a lieu (dépôt de cuivre ou d'argent); on parlera ici de voltamètre gravimétrique. En fin de compte, le but recherché est d'accéder à la quantité d'électricité écoulée durant l'électrolyse par l'application de la loi de Faraday à partir des quantités mesurées (volume ou masse). Ceci implique que le rendement faradique de la réaction électrochimique suivie soit de 100%.
Mesure
- Voltamètre gravimètrique
L'électricité (ou plutôt son intensité) ayant traversé le système est alors mesurée à partir de la pesée de la cathode en cuivre ou en argent. Thomas Edison utilisa ces voltamètres comme instruments de mesures. Un voltamètre d'Hoffmann (à électrodes de platine) ne peut être utilisé comme instrument de mesure gravimétrique en raison de l'inertie chimique du platine, peu favorable à l'électrodéposition.
- Voltamètre volumètrique
L'électricité (ou plutôt son intensité) ayant traversé le voltamètre d'Hoffmann est alors mesurée à partir de la mesure du volume de gaz dans chaque compartiment. Un voltamètre est parfois utilisé comme moyen de démonstration des principes de stœchiométrie, en raison du ratio des volumes d'hydrogène et d'oxygène gazeux produits par l'appareil, qui illustre la formule chimique de l'eau : H2O.
Réaction de réduction cathodique:
Réaction d'oxydation anodique:
Bilan:
Notes et références
Sources
- von Hofmann, A. W. Introduction to Modern Chemistry: Experimental and Theoretic; Embodying Twelve Lectures Delivered in the Royal College of Chemistry, London. Walton and Maberly, London, 1866.
- Cellules électrochimiques :aspects thermodynamiques et cinétiques, Didier Devilliers et Éric Mahé, L’actualité chimique - Janvier 2003 - Article en ligne. (fr) [1].
- Portail de la chimie
Catégories : Électrolyse | Électrochimie | Expérience scientifique | Technologie de l'hydrogène
Wikimedia Foundation. 2010.