- Aérien
-
Air
 Pour les articles homonymes, voir Air (homonymie).
Pour les articles homonymes, voir Air (homonymie).L'air est le mélange de gaz constituant l'atmosphère de la Terre. Il est inodore et incolore. Du fait de la diminution de la pression de l'air avec l'altitude, il est nécessaire de pressuriser les cabines des avions et autres aéronefs. En pratique, la pression imposée dans les cabines est supérieure à la pression extérieure, bien que moindre que la pression au niveau du sol.
L'air comprimé est souvent utilisé dans la plongée sous-marine.
Sommaire
Composition de l'air
L'air sec au voisinage du sol est un mélange gazeux incolore et homogène. Il est approximativement composé en fraction molaire ou en volume de :
Il contient aussi des traces d'hydrogène 0,000072%, mais aussi d'ozone, de radon[1].
L'air typique de l'environnement terrestre est souvent humide car il contient de la vapeur d'eau. Il peut aussi contenir du dioxyde de soufre, des oxydes d'azote, de fines substances en suspension sous forme d'aérosol, des poussières et des micro-organismes.
Au voisinage du sol, l'air contient une quantité très variable de vapeur d'eau, qui dépend des conditions climatiques, et en particulier de la température. En effet le phénomène de saturation de vapeur varie fortement avec la température :
Température de l'air à -10 °C à 0 °C à 10 °C à 20 °C à 30 °C à 40 °C % de vapeur d'eau de 0 à 0,2% de 0 à 0.6% de 0 à 1,2% de 0 à 2,4% de 0 à 4,2% de 0 à 7,6% Ainsi à 4 km d'altitude ( T= -11 °C ), il y a toujours moins de 0,2% de vapeur. Le pourcentage de vapeur d'eau présent dans l'air est mesuré par le taux d'hygrométrie. Cet indicateur est un élément important pour les prévisions météorologiques.
Le taux de dioxyde de carbone varie avec le temps. D'une part, il subit une variation annuelle d'environ 6,5 ppmv (partie par million en volume) d'amplitude. D'autre part, le taux moyen annuel augmente de 1,2 à 1,4 ppmv par an. De l'ordre de 384 ppmv (0,0384 %) à mi-2008, il était de 278 ppmv avant la révolution industrielle, de 315 ppmv en 1958, de 330 ppmv en 1974 et de 353 ppmv en 1990. On pense que ce gaz à effet de serre joue un rôle important dans le réchauffement climatique de la planète.
Le méthane est un autre gaz à effet de serre majeur dont le taux augmente avec le temps : 800 mm3/m3 (0,8 ppmv ) à l'époque préindustrielle, 1585 mm3/m3 en 1985, 1663 mm3/m3 en 1992 et 1676 mm3/m3 en 1996.
La composition de l'air varie avec l'altitude. Elle change également lors de la respiration : l'air exhalé est plus riche en eau et en dioxyde de carbone que l'air inhalé.
Composition de l'air sec Nom Formule Proportion Diazote N2 78,08 % vol Dioxygène O2 20,95 % vol Argon Ar 0,934 % vol Dioxyde de carbone CO2 382 ppmv Néon Ne 18,18 ppmv Hélium He 5,24 ppmv Monoxyde d'azote NO 5 ppmv Krypton Kr 1,14 ppmv Méthane CH4 1,7 ppmv Dihydrogène H2 0,5 ppmv Protoxyde d'azote N2O 0,5 ppmv Xénon Xe 0,087 ppmv Dioxyde d'azote NO2 0,02 ppmv Ozone O3 0 à 0,01 ppmv Radon Rn 6,0×10-14 ppmv Les proportions massiques peuvent être évaluées approximativement en multipliant les proportions volumiques par le rapport de la masse molaire du gaz considéré divisé par la masse molaire de l'air soit 28,976 g/mol, par exemple dans le cas du CO2 ce rapport n' est pas négligeable puisqu'il vaut 44/28,976 = 1,52 d'ou la teneur massique en CO2 dans l'air égale à 382 * 1,52 = 580 ppmm.
Masse volumique
Article détaillé : Masse volumique de l'air.L'air étant un gaz compressible, sa masse volumique (en kg/m3) est fonction de la pression, de la température et du taux d'humidité.
Pour de l'air sec sous pression atmosphérique normale :
On prend généralement 1,293 kg/m3 à 0 °C et 1,204 kg/m3 à 20 °C.
Ceci est généralisé en :
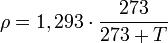 avec T en degrés Celsius.
avec T en degrés Celsius.Potentiel de réchauffement global
Le potentiel de réchauffement global (PRG, GWP Global Warming Potential en anglais) ou équivalent CO2 permet de mesurer la nocivité de chaque gaz à effet de serre. Pour le dioxyde de carbone, il vaut 1 (référence), il est de 23 pour le méthane, 310 pour le peroxyde d'azote (N2O), de 6200 à 7100 pour le dichlorodifluorométhane (CFC), de 1300 à 1400 pour le chlorodifluorométhane (HCFC), 6500 pour le tétrafluorure de carbone 2 (CF4), 6500 pour le hexafluorure de soufre (SF6).
L'indice de réfraction de l'air
L'expression pour l'indice de réfraction d'air « aux conditions standard » est :
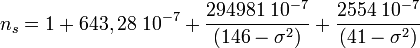
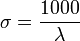 où λ est la longueur d'onde exprimée en nanomètres (nm).
où λ est la longueur d'onde exprimée en nanomètres (nm).là où σ est la réciproque de la longueur d'onde en micromètres.
C'est pour l'air sec avec 0,03% de dioxyde de carbone, à une pression de 101325 Pa (760 millimètres de mercure) et d'une température de 288.15 kelvin (15 °C).
Pour modifier l'indice « ns » pour une température différente ou pression, en utilisant l'une ou l'autre des expressions suivantes :
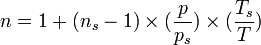
avec :
- T, température en kelvins
- p, pression en pascals
- Ts, 288,15 K
- ps, 101325 Pa
- ns, indice de réfraction d'air donné ci-dessus
ou :
![n = 1 + (n_s-1) \times p \times [ 1 + p \times \beta_{(T)} ] \times (1+ 15 \times \alpha )/{ 760 \times ( 1 + 760 \times \beta_{15}) \times (1 + T \times \alpha) }](/pictures/frwiki/52/44620d597e89181fa5af235caf2b87fd.png)
avec :
- T, température en degrés Celsius
- Ts, 15 °C
- p, pression en mm du mercure
- ps, 760 mm
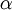 , 0,00366
, 0,00366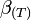 , (1,049 - 0,015*T)*1.e-6
, (1,049 - 0,015*T)*1.e-6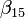 , 8,13e-7
, 8,13e-7- ns, indice de réfraction d'air donné ci-dessus
image de la courbe de l'indice (n)
Propriétés thermophysiques
D'après les tables publiées par Frank M. White, "Heat and Mass transfer", Addison-Wesley, 1988.
avec :
- T, température en kelvins;
- ρ, masse volumique;
- μ, viscosité dynamique;
- ν, viscosité cinématique;
- Cp, chaleur massique à pression constante;
- λ, conductivité thermique;
- a, diffusivité thermique;
- Pr, nombre de Prandtl.
Air à pression atmosphérique T ρ μ ν Cp λ a Pr K kg.m-3 kg.m-1.s-1 m²s-1 J.kg-1.K-1 W.m-1.K-1 m²s-1 - 250 1,413 1,60×10-5 0,949×10-5 1005 0,0223 1.32×10-5 0,722 300 1,177 1,85×10-5 1,57×10-5 1006 0,0262 2,22×10-5 0,708 350 0,998 2,08×10-5 2,08×10-5 1009 0,0300 2,98×10-5 0,697 400 0,883 2,29×10-5 2,59×10-5 1014 0,0337 3,76×10-5 0,689 450 0,783 2,48×10-5 2,89×10-5 1021 0,0371 4,22×10-5 0,683 500 0,705 2,67×10-5 3,69×10-5 1030 0,0404 5,57×10-5 0,680 550 0,642 2,85×10-5 4,43×10-5 1039 0,0436 6,53×10-5 0,680 600 0,588 3,02×10-5 5,13×10-5 1055 0,0466 7,51×10-5 0,680 650 0,543 3,18×10-5 5,85×10-5 1063 0,0495 8,58×10-5 0,682 700 0,503 3,33×10-5 6,63×10-5 1075 0,0523 9,67×10-5 0,684 750 0,471 3,48×10-5 7,39×10-5 1086 0,0551 10,8×10-5 0,686 800 0,441 3,63×10-5 8,23×10-5 1098 0,0578 12,0×10-5 0,689 850 0,415 3,77×10-5 9,07×10-5 1110 0,0603 13,1×10-5 0,692 900 0,392 3,90×10-5 9,93×10-5 1121 0,0628 14,3×10-5 0,696 950 0,372 4,02×10-5 10,8×10-5 1132 0,0653 15,5×10-5 0,699 1000 0,352 4,15×10-5 11,8×10-5 1142 0,0675 16,8×10-5 0,702 1100 0,320 4,40×10-5 13,7×10-5 1161 0,0723 19,5×10-5 0,706 1200 0,295 4,63×10-5 15,7×10-5 1179 0,0763 22,0×10-5 0,714 1300 0,271 4,85×10-5 17,9×10-5 1197 0,0803 24,8×10-5 0,722 D'aprés les informations du site Chemical Professionals voici une relation entre la température et la conductivité thermique de l'air, validé par notamment les valeurs indiquées dans le tableau ci dessus. Elle est valable pour une température comprise entre 100 et 1600 K.
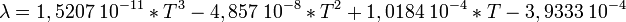
Où
T: Température en [Kelvin]
λ : Conductivité thermique en W.m − 1.K − 1
Voici une relation entre la viscosité cinématique de l'air et la température.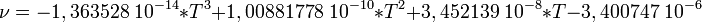
Où
T: Température en [Kelvin]
ν : viscosité cinématique en m2 / s
D'aprés les informations de Ce document du site de la WPI, la relation entre chaleur spécifique de l'air et la température est la suivante :
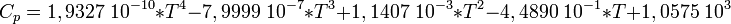
Où
T: Température en [Kelvin]
Cp : Chaleur spécifique en J.kg − 1.K − 1
Liquéfaction de l'air
L'air est formé de différents gaz et ceux-ci, si l'on les refroidit suffisamment, finissent par passer à l'état liquide, puis à l'état solide. Par exemple, l'oxygène devient solide à la température de -218 °C, l'azote se liquéfie à -195 °C. A la température de -270 °C (environ 3 kelvins), tous les gaz sauf l'hélium sont alors solides et on obtient de « l'air congelé »… L'air n'a pu être liquéfié avant que ne soient connues les pressions et températures critiques qui marquent les limites théoriques au-delà desquelles un composé ne peut exister qu'à l'état gazeux. L'air étant un mélange, ces valeurs n'ont pas de sens strict , mais, en fait, à une température supérieure à -140 °C, l'air n'est plus liquéfiable.
Les premières gouttes d'air liquide ont été obtenues presque simultanément par Louis Paul Cailletet et Raoul Pierre Pictet en 1877, par détente brutale entre 300 et 1 atmosphère. En 1894, le physicien néerlandais Heike Kamerlingh Onnes mit au point la première installation d’air liquide. Pendant les quarante années qui suivirent, des chercheurs en France, Grande-Bretagne, Allemagne et Russie apportèrent de nombreuses améliorations au procédé. Sir James Dewar, liquéfia d’abord l’hydrogène, en 1898, et Kamerlingh Onnes l’hélium, le gaz le plus difficile à liquéfier, en 1908. Indépendamment de Carl von Linde, Georges Claude met au point dès 1902 un procédé industriel de liquéfaction de l’air (les brevets qu’il prend à cette occasion sont à l’origine de la société L’Air liquide) et préconise dès 1910, mais en vain, l’utilisation de l’oxygène liquide en sidérurgie. Claude découvre en 1913, avec d’ Arsonval les propriétés explosives de l’air liquide, qui seront utilisées pendant la Première Guerre mondiale (mines à l’air liquide et au noir de fumée).
Symbolique
- Dans un domaine non scientifique, l'air est l'un des quatre éléments (avec le feu, l'eau et la terre) que l'on considéraient autrefois (et que l'on considère encore dans certaines cultures) comme les substances sur lesquels serait basée toute la vie. Il est le symbole de l'Esprit.
- L'air est également souvent associé à différents autres concepts tels que la famille des deniers dans les jeux de tarots.
Notes et références
- ↑ L'air fortement asséché contient en pratique encore des traces de vapeur d'eau.
Voir aussi
- Masse volumique de l'air
- Masse d'air
- Psychrométrie
- Air humide
- Pollution de l'air et les articles de la catégorie : Catégorie:Pollution de l'air
- La voiture à air comprimé
- Portail de la météorologie
- Portail de la chimie
- Portail de la physique
Catégories : Circulation atmosphérique | Gaz inorganique | Théorie de la plongée
Wikimedia Foundation. 2010.
