- Tl2SO4
-
Sulfate de thallium
Sulfate de thallium Général Synonymes Sulfate de thallium (I) No CAS No EINECS PubChem SMILES InChI Apparence cristaux inodores, blancs ou incolores.[1] Propriétés chimiques Formule brute Tl2SO4 Masse molaire 504,829 g∙mol-1
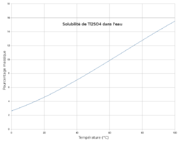
O 12,68 %, S 6,35 %, Tl 80,97 %,Propriétés physiques T° fusion 632 °C[1] Solubilité dans l'eau à 20 °C : 4.87 g/100 ml[1] Masse volumique (eau = 1) : 6.77[1] Précautions Directive 67/548/EEC 
T+
NPhrases R : 28, 38, 48/25, 51/53, Phrases S : 1/2, 13, 36/37, 45, 61, [2] Transport 60 1707 [3]SIMDUT[4] 
SGH[5] 


DangerÉcotoxicologie DL50 25 mg/kg rats Ingestion Unités du SI & CNTP, sauf indication contraire. Le sulfate de thallium, de formule Tl2SO4, est un solide cristallin blanc, inodore et sans goût. On l'utilise comme fourmicide et raticide. Le thallium se substitue au potassium dans le corps, inhibant la pompe sodium/potassium. Il provoque un gonflement du disque optique et une détérioration de la vue.
Traitement :
- charbon actif,
- Bleu de Prusse, ferrocyanure ferrique, K4[Fe(CN)6]3[6].
Les empoisonnements par thallium peuvent être détectés par analyse spectrale, même après la crémation du corps.
De faibles traces d'isotopes radioactifs sont utilisées dans les analyses médicales.
Notes et références
- ↑ a , b , c et d SULFATE DE DITHALLIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « sulfate de dithallium » sur ESIS, consulté le 11 février 2009
- ↑ Entrée du numéro CAS « 7446-18-6 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 novembre 2008 (JavaScript nécessaire)
- ↑ « Sulfate thalleux » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ (en) R H Waring, G B Steventon, S C Mitchell, Molecules of Death Second Edition, Imperial College Press, London 2007, (ISBN 978-1-86094-814-5)
- Portail de la chimie
Catégories : Composé du thallium | Produit chimique très toxique | Produit chimique dangereux pour l'environnement | Sulfate
Wikimedia Foundation. 2010.