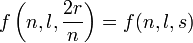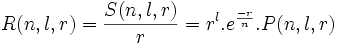- Théorie de schrödinger de l'atome d'hydrogène
-
Théorie de Schrödinger de l'atome d'hydrogène
Cet article est un complément pour l'article sur l'atome d'hydrogène et la Théorie de Pauli de l'atome d'hydrogène.
On considère que les harmoniques sphériques, l'équation 1D de Leibniz-Schrodinger ainsi que l'équation radiale-réduite sont des préacquis.
Pour cet article initial sur l'atome d'hydrogène, on va vérifier directement sur l'équation radiale-réduite en :
et que les valeurs données par les tables mathématiques pour les couches K , L et M, sont exactes:
( Cet article à recours aux équations pour éviter une approche purement descriptive ! ).
Sommaire
Couche K
Pour la couche K, on l'a déjà vu l'orbitale 1s :
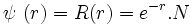 ,
,avec N = 2 pour les couches K , L et M, sont exactes, vérifions-le :
- R(r) est bien orthonormé sur l'intervalle r > 0 ;
- l'équation radiale-réduite est automatiquement satisfaite puisque P = constante et k = 0.
Couche L
Pour la Couche L il y a 1 orbitale 2s , et 3 orbitales 2p :
Orbitales 2p (de Rydberg) :
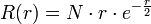 .
.La normalisation conduit à
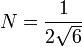 ,
,mais il faudra encore multiplier par
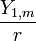 , avec m = − 1,0,1.
, avec m = − 1,0,1.Et avec
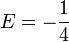 (n = 2, l = 1 donc k = 0), l'équation radiale-réduite est satisfaite, on l'a déjà vu.
(n = 2, l = 1 donc k = 0), l'équation radiale-réduite est satisfaite, on l'a déjà vu.Orbitale 2s : il y a 1 nœud, k = 1:
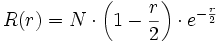 avec
avec 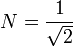 .
.L'équation radiale-réduite est
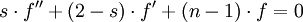 ,
,avec
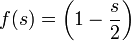 : soit (2 − s)( − 1 / 2) + (n − 1)(1 − s / 2) = 0, ou encore
: soit (2 − s)( − 1 / 2) + (n − 1)(1 − s / 2) = 0, ou encore 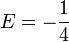 .
.Couche M
Couche M : 1 orbitale 3s , 3 orbitales 3p et 5 orbitales 3d :
Orbitales 3d (de Rydberg) donc
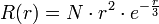 avec
avec 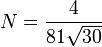 .
.Il faudra multiplier par
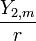 avec m = − 2, − 1,0,1,2.
avec m = − 2, − 1,0,1,2.L'énergie est
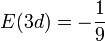 (déjà vu f(s) = cste).
(déjà vu f(s) = cste).Orbitales 3p , avec 1 nœud :
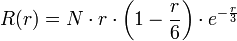 avec
avec 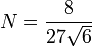 .
.Il faudra multiplier par
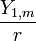 avec m = − 1,0,1.
avec m = − 1,0,1.Montrer que
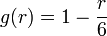 vérifie rg'' + (6 − r)g' + g = 0 est assez facile.
vérifie rg'' + (6 − r)g' + g = 0 est assez facile.Finalement, l'énergie vaut bien
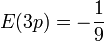 .
.Orbitale sphérique 3s, avec 2 nœuds :
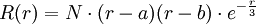 ,
,et cette fois, il faut vérifier que
f(3,0,s) = (s − a')(s − b') = s2 − Ss + P
satisfait à
sf'' + (2 − s)f' + 2f = 0,
ce qui est assez aisé : f est le Polynôme s2 − 6s + 6, soit avec
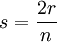 ,
,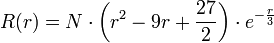 : la probabilité de trouver l'électron voisin de r = a ou r = b, soit
: la probabilité de trouver l'électron voisin de r = a ou r = b, soit 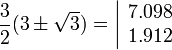 est nulle.
est nulle.Finalement, l'énergie vaut
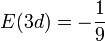 .
.Conclusion
L'énergie la plus basse (n=1, E = E1) correspond à 1seule orbitale 1s. Puis la couche L( n=2 E = E2 = E1/2²)correspond à 1+3 orbitales, une 2s et trois 2p. La couche M ( n=3, E = E3 = E1/3²) correspond à 1+3+5 orbitales, une 3s (avec deux nœuds en 1.9 et 7.1), trois 3p (avec un nœud en r=6) et enfin cinq 3d (sans nœud).
Articles connexes
Liens externes
- Christian Magnan, Texte sur la théorie de Schrödinger
- Portail de la physique
Catégories : Article à recycler (physique) | Atome | Théorie -
Wikimedia Foundation. 2010.