- Réaction de Diels-Alder (Cycloaddition)
-
Réaction de Diels-Alder
Sommaire
Cyclo-additions
La réaction dans laquelle un alcène (diénophile) s'additionne à un diène conjugué pour former un dérivé de cyclohexène est appelée réaction de Diels-Alder. La réaction de Diels-Alder est un cas spécial d'une classe de réactions plus générale: les réactions de cycloaddition entre systèmes π. Dans la réaction de Diels-Alder, les 4 électrons π du diène réagissent avec la double liaison de l'alcène contenant 2 électrons π. Pour cette raison, cette réaction est appelée cycloaddition [4+2]. La réalisation de ces réactions ne nécessite, en général, qu'un simple chauffage.
Règle d'Alder
La facilité de la réaction de Diels-Alder dépend fortement de la nature des substituants du diène et du diénophile.
La réaction prototype ci-dessous, entre le propène et le butadiène, se fait difficilement et donne un rendement en cyclohexène assez faible ~20%.
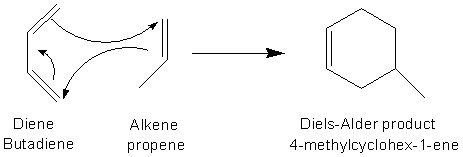
La règle d'Alder permet de préciser les conditions qui facilitent la réalisation de ces cycloadditions.
Règle d'Alder : La réaction s'effectue plus facilement entre un diène riche en électrons et un diènophile pauvre en électrons.
En clair, un "bon" diène est substitué par des atomes ou des groupes d'atomes donneurs d'électrons, un "bon" diénophile par des atomes ou groupes d'atomes attracteurs (accepteurs) d'électrons.
Ces caractères, attracteurs ou donneurs, peuvent être des effets inductifs, mésomères, ou d'hyperconjugaison.
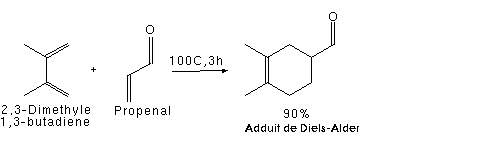
Ci-dessous, la réaction entre le 2,3-diméthyle buta-1,3-diène (2 groupements méthyle donneurs d'électrons), et le propénal (groupement aldéhyde attracteur d'électrons), se fait avec un bon rendement.
Stéréochimie de la réaction
Cette réaction de cycloaddition 2,4 est sous contrôle orbitalaire, ce qui entraîne généralement la formation d'un stéréoisomère endo lorsque le diène est cyclique. On justifie fréquemment cette sélectivité par des considérations frontalières secondaires stabilisant l'approche endo :
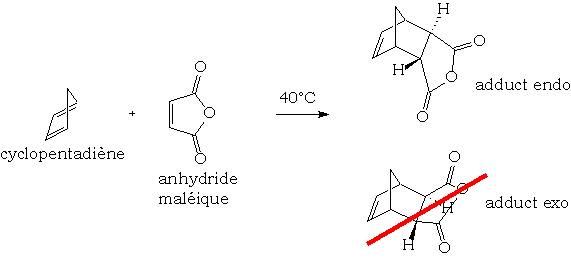
La réaction est réversible. Le composé exo est généralement le plus stable thermodynamiquement. Si on laisse la réaction se prolonger à un temps très long, l'équilibre sera alors en faveur du produit exo.
Caractère renversable
Un aspect intéressant de cette réaction est son caractère renversable. Les réactions inverses, dites de rétro-Diels-Alder peuvent être utilisées pour préparer des composés. Par exemple, le craquage thermique du cyclohexène permet d'obtenir du butadiène et de l'éthène.
En pratique
La réaction de Diels-Alder peut être problématique, par exemple dans le cadre du stockage du cyclopentadiène, qui se dimérise lentement à température ambiante, pour former un composé tricyclique. Ce composé, stable (Teb = 140 °C),doit être distillé lentement pour récupérer le cyclopentadiène (Teb = 41 °C).
Remarques et Références
Otto Paul Hermann Diels et Kurt Alder reçurent le Prix Nobel de chimie 1950 pour ces travaux.
O. Diels and K. Alder, Ann. 460, 98 (1928); 470, 62 (1929) Ber. 62, 2081, 2087 (1929)
- Portail de la chimie
Catégories : Réaction organique | Alcène
Wikimedia Foundation. 2010.
