- Reaction de friedel-crafts
-
Réaction de Friedel-Crafts
Les réactions de Friedel-Crafts sont des réactions chimiques de type substitution électrophile aromatique au cours desquelles un cycle benzènique est alkylé (substitution d'un atome d'hydrogène par un groupement alkyle) ou acylé (substitution d'un atome d'hydrogène par un groupement acyle). Celles-ci ont été developpées en 1877 par le chimiste français Charles Friedel et de son partenaire américain James Crafts.
Sommaire
Alkylation de Friedel-Crafts
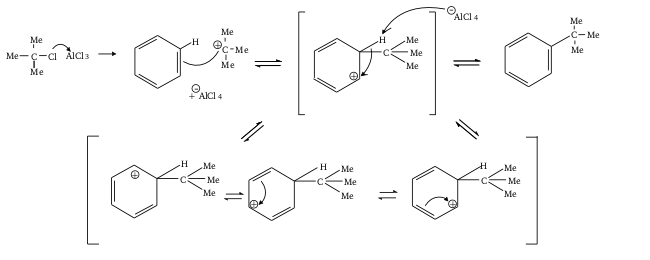
La réaction catalysée par un acide de Lewis, d'un halogénure d'alkyle R-X, et d'un système aromatique est appelée Alkylation de Friedel-Crafts.
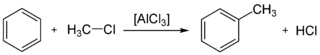
Cette réaction présente un certain nombre d'inconvénients:
- Le produit est plus nucléophile que le réactif. Il s'ensuit qu'il est très difficile de limiter cette réaction à la substitution d'un seul atome d'hydrogène (H). Pour obtenir une bonne séléctivité, il faut conduire cette réaction pendant de longues heures à basse température. Ou alors passer d'abord par l'acylation suivie de la réduction du produit en alkyle.
- La réaction avec un halogénure d'aryle Ar-X (ex: chlorobenzène) ne se prète pas à cette réaction et ne permet pas d'utiliser cette méthode pour coupler deux cycles aromatiques.
- Les solvants et le catalyseur doivent être séparés du mélange réactionel, pour être détruits ou recyclés.
Les acides de Lewis les plus utilisés sont: AlX3 (X = Br, Cl, I), SbF5, ZnCl2
Mécanisme
Utilisations
Cette réaction est utilisé tant au laboratoire que dans l'industrie comme par exemple dans la synthèse du toluène
Références
- Friedel, C.; Crafts, J.M. Compt. Rend., 1877, 84, 1392, 1450.
- Price, C.C. Org. React., 1946, 3, 1.
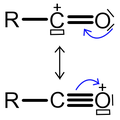
Acylation de Friedel-Crafts
La réaction catalysée par un acide de Lewis, d'un halogénure d'acyle RCOX ou d'un anhydride d'acyle, et d'un système aromatique est appelée Acylation de Friedel-Crafts.
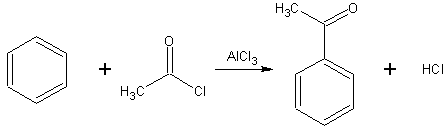
Les conditions de la réaction sont similaires à celles de l'alkylation présentée ci-dessus. Contrairement au cas de l'alkylation, il ne peut pas y avoir d'acylations multiples. En effet, le groupement carbonyle, attracteur d'électrons, désactive le noyau aromatique si bien que le produit de la réaction est moins réactifs que le produit initial. De plus, il ne peut pas y avoir de réarrangement du carbocation (ion acylium) dans le cas de l'acylation. En revanche, le catalyseur forme un complexe avec le produit final et il en faut une quantité légèrement supérieure au nombre de moles de groupements carbonyle présents dans l'agent acylant.
Voir aussi
- Portail de la chimie
Catégorie : Réaction de substitution
Wikimedia Foundation. 2010.