- Pont électrolytique
-
Pont salin
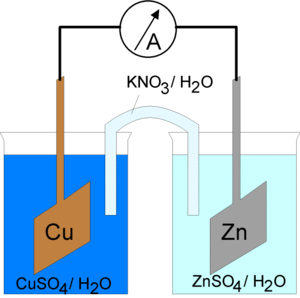
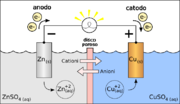
Un pont salin, en électrochimie, est un petit équipement de laboratoire utilisé pour connecter deux compartiments d'une cellule galvanique, un type de cellule électrochimique. Chacun des compartiments contient une solution contenant l'oxydant et le réducteur d'un couple redox (chaque compartiment est une demi-cellule). Le pont salin contient un électrolyte inerte du point de vue électrochimique et permet donc la conduction d'un courant électrique entre les deux demi-cellules sans que les deux solutions ne se mélangent.
Sommaire
Rôle
Dans une cellule galvanique, le passage du courant électrique est assuré par le déplacement des électrons dans le circuit métallique (circuit extérieur) et des ions dans les deux demi-piles. Entre les deux compartiments de la pile, les solutions sont mises en reliées du point de vue de la conduction électrique par un pont salin constitué contenant des sels tels que le chlorure de potassium KCl ou nitrate de potassium KNO3. Les cations et les anions du pont salin peuvent migrer vers un compartiment ou l'autre afin d'assurer la neutralité électrique dans les deux compartiments de la cellule. En revanche, les solutions ne sont pas mélangées, ce qui permet d'éviter des réactions redox indésirables. Lors de la réaction redox, les électrons quittent un comportement de la cellule galvanique pour l'autre créant une différence de charge violant la neutralité électrique des solutions. Sans pont salin, cette situation aboutirait à l'arrêt du courant électrique entre les deux demi-cellules.
Tubes de verre
Un type de ponts salins est construit avec un tube de verre en forme de U. Ce tube est rempli d'un gel. Ce gel est souvent constitué d'agar-agar
Préparation du gel utilisé dans ce type de pont salin
- faire bouillir 100 mL d'eau
- dissoudre dans la solution bouillante 30 g de KNO3 ou KCl ou NH4NO3
- arrêter de chauffer. Dissoudre 3 g d'agar-agar en poudre. Agiter.
- remplir à l'aide d'une seringue les tubes en U avec le mélange réalisé
- laisser refroidir
- le pont peut être conservé plusieurs jours. Evitez cependant le dessèchement des extrémités.
La conductivité de ce type de pont salin dépend de la concentration de la solution d'électrolyte. Une augmentation de la concentration en dessous de la limite de saturation augmente la conductivité. Après la saturation, la conductivité peut chuter le tube étant bouché par les sels à l'état solide.
Ponts salins à base de papier-filtre
On peut aussi utiliser un papier-filtre, trempé avec une solution contenant un électrolyte inerte. Dans ce cas il n'y a pas de gel car le filtre trempé est suffisamment conducteur.
La conductivité de ce type de pont salin dépend de nombreux facteurs (la texture du papier, la concentration de l'électrolyte, la capacité d'absorption du papier...) .
Voir aussi
Articles connexes
- Portail de la chimie
Catégorie : Électrochimie
Wikimedia Foundation. 2010.