- Pentachlorophénol
-
Pentachlorophénol 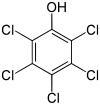
Général No CAS
(Na)No EINECS (Na) Apparence cristaux blancs ou solide de forme variable, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C6HCl5O [Isomères] Masse molaire[2] 266,337 ± 0,015 g·mol-1
C 27,06 %, H 0,38 %, Cl 66,56 %, O 6,01 %,Propriétés physiques T° fusion 191 °C[1] T° ébullition (décomposition) : 309 °C[1] Solubilité dans l'eau à 20 °C : 0,01 g·l-1[1] Masse volumique 1.98[1] Pression de vapeur saturante à 20 °C : 0,02 Pa[1] Précautions Directive 67/548/EEC 
T+
NPhrases R : 24/25, 26, 36/37/38, 40, 50/53, Phrases S : (1/2), 22, 36/37, 45, 52, 60, 61, Transport - 3155 NFPA 704 SIMDUT[3],[4] Pentachlorophénol :

Pentachlorophénate de sodium :

SGH[5],[6] 


Danger



DangerInhalation Très toxique. Peau Irritant. Yeux Irritant. Ingestion Toxique. Écotoxicologie LogP 5,01[1] Unités du SI & CNTP, sauf indication contraire. Le pentachlorophénol (PCP) est une molécule de formule C6HOCl5.
Il est délicat de maîtriser la combustion du bois traité avec des chlorophénols tels que le pentachlorophénol (PCP), qui produit en brûlant une grande diversité de dioxines. Un mélange de pentachlorophénol et de 2,3,4,6-tétrachlorophénol aboutit à un herbicide courant, qui est aussi un insecticide. On peut craindre la formation de dioxines chaque fois que l’on brûle des composés organiques chlorés, sauf si la combustion est réalisée à une température supérieure à 1 200 °C.
Sommaire
Utilisation
Il s'agit d'un fongicide qui a prouvé son efficacité pour le traitement du bois et le blanchiment de la pâte à papier(il atténue le noircissement provoqué par les champignons).
En raison de la nocivité du produit pour l'homme et l'environnement, les usages de ces composés sont sévèrement réglementés. En France le décret du 7 juillet 1994 interdit la mise sur le marché de produit en contenant plus de 0,1 %, toutefois des dérogations pour notamment:
- Pour la préservation des bois destinés à certains usages (sont exclus les bois servant à la fabrication de meubles ou d'emballages alimentaires)
- Pour l'imprégnation de fibres et textiles non destinées à l'habillement ou l'ameublement.
- Comme agent de synthèse ou de transformation dans des prôcédés industriels.
- Pour le traitement in situ des bâtiments d'intérêt historique et culturel (autorisé au cas par cas).
Toxicocinétique
La pénétration dans l'organisme est à la fois respiratoire et cutanée (la voie cutanée serait prédominante)
La VME a été fixée à 0,5 mg·m-3
Toxicité pour l'homme
Les aérosols sont irritants pour les yeux, le nez et les voies aériennes supérieures. Les solutions ont une action irritantes sur la peau, elles peuvent provoquer des brûlures allant jusqu'à des phlyctènes.
Des cas d'intoxication graves pouvant aller jusqu'à une issue mortelle ont été observés.
- Apparition de céphalées, sueurs, hyperthermie, tachycardie, dyspnée.
- Signes d'irritation des muqueuse, atteinte hépatique et rénale.
- Dans les cas sévères coma hyperthermique et convulsif avec cytolyse hépatique.
Liens externes
Références
- PENTACHLOROPHENOL, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Pentachlorophénol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Pentachlorophénate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Catégories :- Produit chimique très toxique
- Produit chimique dangereux pour l'environnement
- Cancérogène chimique
- Pollution
Wikimedia Foundation. 2010.

