- Leontopithecus rosalia
-
Tamarin lion doré
Petit singe-lion doré

Tamarin lion doré
(Leontopithecus rosalia)Classification classique Règne Animalia Embranchement Chordata Classe Mammalia Ordre Primates Famille Callitrichidae Genre Leontopithecus Genre Leontopithecus
(Lesson, 1840)Nom binominal Leontopithecus rosalia
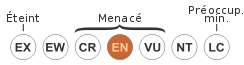
(Linnaeus, 1766)Statut de conservation IUCN :
Statut CITES :  Annexe I ,
Annexe I ,
Révision du 1975-01-07
D'autres documents multimédia
sont disponibles sur Commons Retrouvez ce taxon sur Wikispecies
Retrouvez ce taxon sur WikispeciesParcourez la biologie sur Wikipédia : Le Tamarin lion doré ou Petit singe-lion doré (Leontopithecus rosalia) est une espèce de primate de la famille des Callitrichidae.
Autres noms
Golden lion tamarin. Mico-leão-dourado au Brésil.
Distribution
On le trouve dans l'est du Brésil, au centre et au sud du littoral de l’État de Rio de Janeiro. Sur une aire totale à peine supérieure à 100km² recouvrant seulement quelques municipalités [essentiellement Saquarema, Araruama (Macaé de Cima), São Pedro da Aldeia et Cabo Frio sur le littoral, et juste au nord Silva Jardim, Aldea Velha, Casimiro de Abreu et Rio das Ostras dans le bassin du Rio São João. En 2006, il a été trouvé dans le PM de Taquara (municipalité de Duque de Caxias), qui constitue à ce jour la limite australe de l’espèce. Au XIXe siècle, cette espèce occupait aussi l’état d’Espírito Santo (au sud du Rio Dôce) sur une aire totale de 14 000km².
Habitat
Il vit dans la forêt tropicale côtière de la Mata Atlântica riche en broméliacéesà une altitude comprise entre le niveau de la mer et 300m d’altitude (une micropopulation a été observée à 550m d’altitude dans la Serra do Mar)où la saison sèche de mai à juillet-août. Il affectionne la forêt primaire, s’accommode tant bien que mal de la forêt secondaire (comme à Poço das Antas) et ne survit pas dans les zones cultivées. Il doit subsister dans des forêts toujours plus dégradées et morcelées. Sympatrie et association : En hiver dans la fazenda Rio Vermelho, il s’assiocie 65% du temps avec l’ouistiti du Nordeste (Callithrix jacchus).
Description
Sa fourrure est dorée, orangée, rougeâtre ou chamois. D’ordinaire, seules la face et les mains sont nues et sombres. Toutefois, certains spécimens présentent une croupe sombre ou une tache sombre sur le flanc ou un appendice caudal sombre (totalement ou bien seulement une ou deux sections de la queue nettement délimitées). En captivité, si la nourriture est pauvre en caroténoïdes, le pelage devient sombre. Les doigts sont fins et longs adaptés à la récolte d’insectes dans les anfractuosités ou sous l’humus (micromanipulation).
Les nouveau-nés ont un pelage doré pâle, plus clair que celui de l’adulte.
Mensurations
Corps 26cm (de 20 à 33,6cm). Queue 37cm (de 31 à 40cm). Poids 437 à 710g (M) et 361 à 794g (F). Le poids du mâle augmente en mai et décroît de 12% en juin. Cerveau : 12,9g. Rapport longueur bras/jambes (x100) : 86,7.
Domaine
Le territoire mesure de 36 à 67 ha (d’après Dietz et al.). Il est défendu activement par des marquages olfactifs, des cris et des démonstrations visuelles.
Densité
12/km² (Poço das Antas). 6/km² (fazenda Rio Vermelho).
Locomotion
Quadrupède.
Comportements basiques
C'est un animal diurne. Arboricole, il descend parfois à terre.
Comportements divers
Dans le parc zoologique de Sainte-Augustine (Floride), on l’a observé épouiller le dos d’un papegeai maillé (Deroptyus accipitrinus).
Activités
Il parcourt chaque jour 1,339 à 1,533 km (d’après Dietz et al.). Voyage entre 10 et 30 m au-dessus du sol et cherche les insectes plus bas entre 5 et 10 m. Tout juste éveillé, le mâle adulte grimpe à la cime pour y prendre un bain de soleil, bientôt suivi par le reste de la famille. Repas matinal. Après la sieste de midi sur un tronc oblique, les jeunes batifolent, multipliant les poursuites et les parties de catch. La mère repart alors en quête de nourriture, laissant à son compagnon la garde des jumeaux nouveau-nés. À la nuit tombante, après la rituelle séance d’épouillage, toute la famille réintègre son antre, le mâle rentrant en dernier tout en surveillant les environs. Le groupe dispose d’une vingtaine d’abris, mais seuls deux ou trois troncs sont régulièrement habités. Les trous doivent avoir au moins 10 cm de diamètre, souvent ceux de vieux arbres en décomposition, à l’abri des trombes d’eau et des prédateurs. Les grandes broméliacées de plus de 70 cm de large constituent d’autres sites nocturnes prisés.
Alimentation
C'est un animal frugivore,faunivore et exsudativore. Il n’hésite pas à descendre de son perchoir pour chasser aussi bien à terre que dans les arbres avec une prédilection pour les broméliacées, la couronne des palmiers et les feuilles de palmiers morts. Les proies sont localisées au toucher plutôt qu’à la vue (c’est l’inverse chez les ouistitis). Il fouille la litière de feuilles des palmiers, gratte l’écorce pourrie, inspecte les crevasses. Il se nourrit d'insectes (blattes, orthoptères, lépidoptères, larves de coléoptères), araignées (araignées-loups et mygales), vers de terres, escargots, lézards, grenouilles arboricoles, crapauds, œufs d’oiseau. L’alimentation végétale reste prédominante. Dans la RB d’União, il consomme 57 espèces de fruits d’au moins 17 familles, davantage de couleur jaune (40,3%) que noire ou violette (28,1%) ou rouge (14%), avec une prédilection pour les graines oblongues, notamment des espèces des genres Cecropia, Tapirira, Rollinia, Pouteria, Passiflora, Miconia et Henriettea. À Poço das Ontas, une quarantaine d’espèces de plantes d’une vingtaine de familles différentes entrent dans son régime, les fruits (38 espèces) venant loin devant les fleurs (3 espèces) et les exsudats (3 espèces). Pendant la saison sèche (mai à août), il absorbe ici des exsudats végétaux. On le voit mordre la base des lianes Machaerium pour provoquer un écoulement de sève. Boit dans le creux d’une branche en mettant la main à la bouche ou en lapant directement au cœur d’une broméliacée (plante-abreuvoir universelle pour les mammifères arboricoles de la forêt). En captivité, il utilise des rameaux et l’antenne de son collier-émetteur pour extraire des insectes sous l’écorce et pour se toiletter mutuellement ou personnellement.
Taille du groupe
Il vit généralement en groupe de 5 à 6 individus (de 2 à 16).
Structure sociale et système de reproduction
La structure sociale est variable. Groupe unimâle ou groupe multimâle-multifemelle. À Poço das Antas, la grande majorité des groupes inclut soit plusieurs mâles adultes, soit plusieurs femelles adultes. Polygynie ou polyandrie. Monogamie rare. Polygynie stable avérée. Polyandrie peut-être conjoncturelle (correspondant à une période de transition au sein du groupe). Globalement, 40% des groupes comprennent deux mâles adultes non apparentés à la femelle reproductrice et 70% des mâles adultes participent à la reproduction mais le dominant à tendance à monopoliser sa partenaire. De même, quelques femelles subordonnées se reproduisent (dans 10,6% des 211 groupes étudiés), seulement en l’absence d’agression de la part des femelles dominantes, et la chance de survie de leur progéniture est deux fois plus faible que celle dominantes.
Hiérarchie
Équilibre des sexes. Il semblerait toutefois que le sexe qui fonde le groupe établirait une dominance s’exprimant par la préséance alimentaire.
Dispersion
Les individus des deux sexes émigrent: les jeunes femelles partent les premières, à l’inverse de ce que l’on observe chez la plupart des autres primates, en raison de la compétition intrasexuelle, tandis que les mâles se dispersent pour éviter la consanguinité. Seules un quart des femelles immigrantes parviendront à intégrer une nouveau clan.
Reproduction
La parade sexuelle inclut des reniflements, de l’épouillage mutuel et des mouvements rapides de la langue. La copulation se déroule en position dorsoventrale. La période de reprodution commence en mai. La femelle met bas pour la première fois autour de 29 mois et connaît un œstrus post-partum 3 à 10 jours après la mise bas. Une ou deux fois par an, des jumeaux viennent au monde après une gestation variant entre 125 et 132 jours. La saison des naissances s’étale entre septembre et mars, qui est la période la plus chaude et la plus humide de l’année, avec un pic à la fin octobre.
Développement
La mère transporte seule ses jumeaux durant les deux premières semaines, plus longtemps encore en cas de naissance unique, leur donnant plusieurs fois par jours un lait très riche en protéines. Puis, elle les transfert au père. Chez les autres callitrichidés, la prise en charge est bien plus précoce, parfois dès le premier ou deuxième jour. Tous les membres du groupe participent à l’élevage des jeunes (transport, toilettage, partage de la nourriture). Les individus mâles ont tendance à transporter plus souvent les jeunes mâles que les jeunes femelles. Dès 3 semaines, commence à ingérer des aliments solides, à 5 semaines explore seul son environnement, à 3 mois peut voyager seul et exhibe ses premiers comportements sexuels (marquage circumgénital et sternal, monte simulée). Maturité sexuelle vers 2 ans.
Longévité
Il vit jusqu’à 14-15 ans (en captivité).
Communication orale
17 vocalisations différentes, notamment trilles, gémissements ultrasoniques, gloussements et cris de vigilance. Répertoire similaire à celui du petit singe-lion à tête dorée (Leontopithecus chrysomelas). Il existe un certain dimorphisme sexuel dans ces appels. Pour avertir de la présence d’un prédateur, il pousse une série de gloussements anxieux. Si le danger vient du ciel (rapace), il change de registre et émet des pépiements caractéristiques. L’appel typique est un appel long de 3 phrases (cri de départ, gémissements et gloussements), produit à fin territoriale ou pour raffermir les liens du couple. L’une de ces trois phrases peut être émise individuellement et véhiculer un sens différent (cri de départ pour marquer sa position, gloussements contre les prédateurs terrestres). Les deux premières phrases sont parfois seules émises (cri de cohésion). Cri suraigu de détresse (enfant).
Communication visuelle
Au nombre des démonstrations visuelles agressives de cette espèce, citons les regards fixes, les dents révélées, le dos arqué, le hérissement des poils (piloérection) et les battements de queue.
Communication olfactive
Le marquage olfactif s’avère plus fréquent que chez les autres callitrichidés et il utilise davantage les glandes sternales que circumgénitales.
Communication tactile
Pelotonnage.
Prédateurs
Aigles. Ocelot. Boa constrictor.
Menaces
Déforestation, pâturage, agriculture et charbonnage. 40% de l’habitat où il survit n’est pas protégé.
Effectifs
~1000 (en 2002). ~250 dans la RB de Poço das Antas et ~ 200 (30 groupes) dans la RB d’União
Conservation
RB de Poço das Antas (comté de Silva Jardim), RB d’União (entre Casimiro de Abreu et Rio das Ostras) et PM de Taquara, dans l’État de Rio de Janeiro (Brésil). Conservé dans 27 fazendas, les principales étant : Rio Vermelho (62 individus) - ville de Rio Bonito juste à l’ouest de Silva Jardim -, Dos Irmãos (38), São Francisco (28), Coqueiro (28), Santa Helena (26), Iguape (26), Igarape (18), Maratua (16), Estreito (11) + Sanctuaire de Bom Retiro (8) - ville d’Aldeia Velha juste à l’ouest de Casimiro de Abreu.
Statut
En grand danger.
Voir aussi
- Translocation as a Metapopulation Management Tool for the Black Lion Tamarin, Leontopithecus chrysopygus, par Emília Patrícia Medici, Cláudio B. Valladares-Pádua, Anthony B. Rylands et Cristiana Saddy Martins, in Primate Conservation, n°19, 2003.
Références
- Référence ITIS : : Leontopithecus rosalia (fr) ( (en))
- Référence IUCN : espèce Leontopithecus rosalia (en)
- Référence CITES : espèce Leontopithecus rosalia (+répartition) (sur le site de l’UNEP-WCMC) (fr+en)
- Portail de la zoologie
Catégories : Statut IUCN En danger | CITES annexe I | Mammifère (nom vernaculaire) | Platyrrhini
Wikimedia Foundation. 2010.