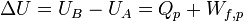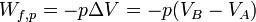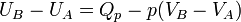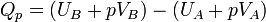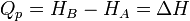- Isenthalpique
-
Enthalpie
Potentiels thermodynamiques Énergie interne U(S,V,N) Énergie libre F(T,V,N) = U − TS Enthalpie H(S,p,N) = U + pV Enthalpie libre G(T,p,N) = U + pV − TS modifier L'enthalpie (du préfixe en- et du grec thalpein : « chauffer »[Note 1]) est une fonction d'état extensive de la thermodynamique, dont la variation permet d'exprimer la quantité de chaleur mise en jeu pendant la transformation à pression constante (isobare) d'un système thermodynamique au cours de laquelle celui-ci reçoit ou fournit un travail mécanique.
Sommaire
Définition
Considérons une transformation isobare au cours de laquelle le système passe d’un état A à un état B d’équilibres en échangeant de la chaleur
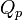 et du travail uniquement par l’intermédiaire des forces de pression
et du travail uniquement par l’intermédiaire des forces de pression 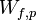 .
.Le premier principe permet d’écrire :
U étant la fonction d'état énergie interne
À pression constante le travail des forces de pression est égal à :
Donc
D'où :
On définit ainsi une nouvelle fonction d’état, la fonction enthalpie
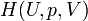
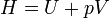
Il s'ensuit que :
Par conséquent, à pression constante, la chaleur mise en jeu, qui n’est pas une fonction d’état puisque c'est un transfert d'énergie entre le système et le milieu extérieur, devient égale à la variation de la fonction d’état enthalpie H. La variation de cette fonction ne dépend que de l’état final et de l’état initial du système et est indépendante du chemin suivi par la transformation.
C’est tout l’intérêt de l’application de la fonction enthalpie dans les cas très courants de transformations effectuées à l’air libre, à pression atmosphérique constante.
Cette propriété est à la base de la calorimétrie à pression constante. Par abus de langage on confond souvent les termes chaleur et enthalpie.
Propriétés
L'enthalpie a la dimension d'une énergie, et s'exprime en joules dans le Système International.
La propriété mathématique induite pour toute fonction d'état implique que sa différentielle est totale exacte c'est-à-dire qu'elle est égale à la somme des différentielles partielles par rapport à chaque variable.
Différentielle de l'enthalpie
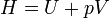
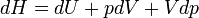
- Appliquons le premier principe
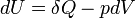
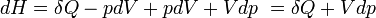
- Appliquons le second principe
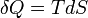 si la transformation est réversible.
si la transformation est réversible.d'où
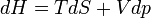
Application de l'enthalpie aux réactions chimiques effectuées à T et p constantes
Dans le cas d'une réaction chimique effectuée à T et p constantes, il a été défini une grandeur de réaction appelée enthalpie de réaction, associée à l'équation bilan de la réaction:
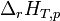 . Cette grandeur de réaction permet d'avoir accès à la chaleur mise en jeu au cours de cette réaction. Le calcul de cette grandeur peut être effectué grâce aux valeurs de l'enthalpie standard de formation de chaque constituant intervenant dans la réaction:
. Cette grandeur de réaction permet d'avoir accès à la chaleur mise en jeu au cours de cette réaction. Le calcul de cette grandeur peut être effectué grâce aux valeurs de l'enthalpie standard de formation de chaque constituant intervenant dans la réaction: 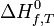 . Les valeurs ont été consignées dans des tables thermodynamiques, établies à la température de référence de 298K.
. Les valeurs ont été consignées dans des tables thermodynamiques, établies à la température de référence de 298K.Exemple de relation entre enthalpie standard de formation et enthalpie de réaction: combustion d'un alcane
Calcul de l'enthalpie de combustion du méthane à 298K sous la pression standard:
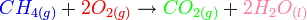
La loi de Hess permet d'écrire: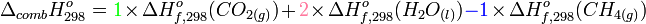
L'enthalpie standard de formation du dioxygène est nulle car c'est un corps pur simple stable dans les conditions choisies (voir enthalpie standard de formation).
Le calcul de cette enthalpie de combustion permet la détermination de la chaleur de réaction ( voir enthalpie de réaction). Inversement, si l'on mesure cette chaleur à l'aide d'une bombe calorimétrique, on peut avoir accès à l'enthalpie standard de formation du méthane.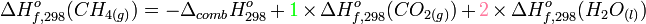
État standard
État standard (conditions standards) : état de référence pour réactifs et produits : corps pur à p0= 1 bar ; T = cte ; C0 = 1 mol.L-1 pour un soluté.
État standard de référence : état physique le plus stable à p0 = 1 bar et T = cte.
Détente isenthalpique
Une détente isenthalpique est une réaction où l'enthalpie ne varie pas. Un bon exemple est la détente de Joule-Thomson.
Notes
- ↑ Le mot serait la création de Heike Kamerlingh Onnes selon l’Histoire générale des sciences (t. 3, vol. 1, 1961, p. 282): « La nouvelle fonction thermodynamique (...), qui reçut de Kamerlingh Onnes le nom d'« enthalpie », joue, pour les transformations à pression constante, le rôle que joue l'énergie interne pour les transformations à volume constant. »
Voir aussi
- Enthalpie libre
- Enthalpie de réaction
- Enthalpie standard de formation
- Thermochimie
- Transfert thermique
- Diagramme d'enthalpie
- Enthalpie de vaporisation
- Entropie
- Gaz parfait
- Loi de Joule
- Température
- Fonction d'état, variable d'état, équation d'état
- Calorimétrie différentielle à balayage
- Portail de la physique
- Portail de la chimie
Catégories : Grandeur physique | Thermochimie | Thermodynamique
Wikimedia Foundation. 2010.