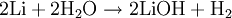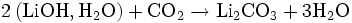- 1310-66-3
-
Hydroxyde de lithium
Hydroxyde de lithium 
Général Nom IUPAC Hydroxyde de lithium No CAS (anhydre)
(monohydrate)No EINECS SMILES InChI Apparence cristaux incolores, hygroscopiques. (monohydrate)[1] Propriétés chimiques Formule brute LiOH Masse molaire 23,948 g∙mol-1
H 4,21 %, Li 28,98 %, O 66,81 %,pKb -2,36 Propriétés physiques T° fusion 450 à 471 °C (monohydrate)[1] T° ébullition (décomposition) : 924 °C (monohydrate)[1] Solubilité dans l'eau à 20 °C : 10.9 g/100 ml (monohydrate)[1],
12,8 g/100 ml (20 °C,eau)Masse volumique anhydre 2,54 solide,
monohydrate 1,51Thermochimie S0solide 42.81 J.K-1.mol-1 ΔfH0solide -484.93 kJ/mol Précautions Transport - 2679
- 2680 SIMDUT[2] 
Unités du SI & CNTP, sauf indication contraire. L’hydroxyde de lithium (LiOH, CAS : 1310-65-2), aussi appelé lithine, est une base corrosive, produite lors du mélange de lithium et d'eau :
Il est analogue à la soude (NaOH) et la potasse (KOH), bien que certaines de ses propriétés soient uniques. Son principal avantage par rapport à celles-ci concerne sa faible masse et sa plus grande densité, ce qui rend ses utilisations en milieu confiné plus pratiques.
Propriétés
L'hydroxyde de lithium se présente sous la forme d'un cristal blanc hygroscopique. Il est soluble dans l'eau (12,8 g/100 ml à 20 °C), et faiblement dans l'éthanol. Il fond à 471 °C.
Utilisations
L'hydroxyde de lithium est utilisé lors des missions spatiales[3] et dans les sous-marins pour purifier l'air. En effet, l'hydroxyde de lithium réagit avec le dioxyde de carbone :
D'autres utilisations le font intervenir dans les synthèses de polymères ou comme électrolyte dans les accumulateurs.
Il est également utilisé par l'industrie nucléaire pour le conditionnement des circuits : il vient y contrer l'acidité de l'acide borique (lui-même injecté comme neutrophage). Le choix s'est porté sur lui car une faible partie du bore 10 se transforme en Lithium par réaction B(n, alpha)Li (environ 2%).
Notes et références
- ↑ a , b , c et d HYDROXYDE DE LITHIUM, MONOHYDRATE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Hydroxyde de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Par une manipulation in extremis, l'équipage de la mission Apollo 13 survécut en exploitant cette réaction.
- Portail de la chimie
Catégories : Composé du lithium | Produit chimique corrosif | Hydroxyde
Wikimedia Foundation. 2010.