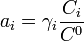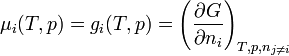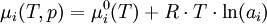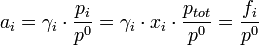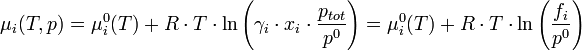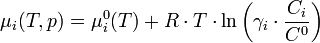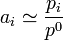- Fugacité
-
Activité chimique
L'activité chimique d'une espèce chimique (atome, molécule, ion, etc...) correspond à la concentration active de cette espèce. En effet, au sein d'une solution les interactions d'ordre électrostatique entre les différentes espèces amoindrissent leur potentiel de réactivité. Il faut donc corriger le terme de concentration par un coefficient inférieur à l'unité, appelé coefficient d'activité,
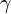 .
.L'activité s'exprime pour un constituant i en solution, à la concentration Ci :
L'activité intervient dans la définition du potentiel chimique.
Le potentiel chimique
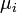 d'une espèce i est la dérivée partielle de l'enthalpie libre (ou énergie libre de Gibbs) du système par rapport à la quantité de matière
d'une espèce i est la dérivée partielle de l'enthalpie libre (ou énergie libre de Gibbs) du système par rapport à la quantité de matière 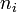 : c'est une grandeur molaire partielle qui correspond ici à l'enthalpie libre molaire,
: c'est une grandeur molaire partielle qui correspond ici à l'enthalpie libre molaire, 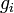 du constituant i.
du constituant i.Ce potentiel chimique dépend de la température T, de la pression p et de l'activité ai selon la formule :
où
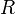 est la constante des gaz parfaits et
est la constante des gaz parfaits et 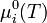 est la valeur de
est la valeur de 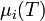 dans les conditions standard de pression.
dans les conditions standard de pression.Sommaire
Cas d'un composé dans un mélange gazeux
L'activité s'exprime sous la forme :
où
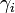 est le coefficient d'activité (
est le coefficient d'activité ( 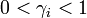 , sans dimension) de l'espèce i ;
, sans dimension) de l'espèce i ; 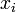 la fraction molaire du composé dans le mélange gazeux ;
la fraction molaire du composé dans le mélange gazeux ; 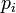 la pression partielle du gaz i et
la pression partielle du gaz i et 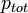 la pression totale du mélange exprimée en bar.
la pression totale du mélange exprimée en bar.La quantité
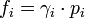 a la dimension d'une pression et est nommée fugacité.
a la dimension d'une pression et est nommée fugacité.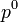 est la pression standard. Par convention, elle est égale à 1 bar.
est la pression standard. Par convention, elle est égale à 1 bar.On a alors :
Remarque :
- Pour un gaz parfait, le coefficient d'activité
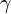 est égal à 1.
est égal à 1.
Cas d'un composé dans une solution liquide
L'activité s'exprime sous la forme :
où
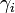 est le coefficient d'activité de l'espèce i,
est le coefficient d'activité de l'espèce i, 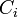 sa concentration dans la solution, exprimée en mol·L-1. Le terme
sa concentration dans la solution, exprimée en mol·L-1. Le terme 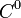 (concentration de référence), est égal, par convention, à 1 mol·L-1. On a alors :
(concentration de référence), est égal, par convention, à 1 mol·L-1. On a alors :Dans une solution liquide, le coefficient d'activité d'un ion isolé n'est pas mesurable car il est expérimentalement impossible de mesurer le potentiel électrochimique d'un ion, indépendamment des autres ions présents dans la solution. C'est pourquoi on introduit la notion de coefficient d'activité moyen.
Approximations usuelles
On peut simplifier les relations ci-dessus en considérant que :
- Pour une solution :
- Le solvant est l'espèce très majoritaire. Il peut donc être assimilé à une phase pure et son activité est alors égale à 1.
- Lorsque la concentration d'un soluté est faible, son coefficient d'activité
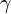 est voisin de 1. Cela entraîne que l'activité devient égale au rapport de sa concentration sur la concentration de référence :
est voisin de 1. Cela entraîne que l'activité devient égale au rapport de sa concentration sur la concentration de référence :
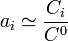 .
.
- Pour un mélange de gaz : l'activité est égale au rapport de la pression partielle du gaz sur la pression standard, tant que cette pression garde des valeurs faibles ce qui entraîne que
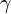 est proche de 1 ;
est proche de 1 ;
- Pour un corps pur l'activité est égale à 1.
L'activité chimique intervient dans l'expression de la constante d'équilibre.
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Thermochimie | Chimie générale | Électrochimie
Wikimedia Foundation. 2010.