- Feuillet bêta plissé
-
Feuillet bêta
Les feuillets bêta ou Feuillets bêta plissé sont des structures secondaires qui s'observent dans des portions de protéines. (cf Structure des protéines)
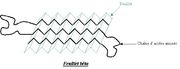
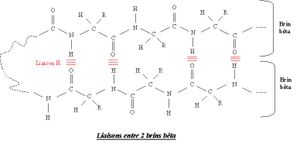
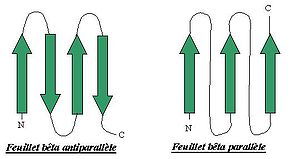
Ils se matérialisent sous forme d'un pli successif avec différentes ondulations de la chaîne polypeptidique (comme un accordéon). C'est une structure plus lâche et plus plane que l'hélice alpha. Un feuillet bêta donnera lieu à des interactions d'acides aminés d'une même chaîne polypeptidique qui sera repliée sur elle même. La distance entre les groupements CO et NH qui forment des liaisons hydrogènes (liaison faible, non covalente) est de 0 70 nm (plus que dans les hélice alpha, donc plus lâche). Au final la chaîne polypeptidique est plus étirée lorsqu'elle forme un feuillet bêta plissé que lorsqu'elle forme une hélice alpha.Il existe 2 types de dispositions de feuillets bêta : feuillets bêta antiparallèles et feuillets bêta parallèles. Les feuillets bêta antiparallèles sont plus fréquents que la seconde disposition. Ils interviennent lorsque la chaîne polypeptidique se replie sur elle-même, ils sont dits antiparallèles car pour une partie de la chaîne les acides aminés sont dans un ordre particulier (C-N) et pour l'autre ils sont dans le sens inverse (N-C). On retrouve des feuillets bêta parallèles lorsque la chaîne a fait 2 ou un multiple de 2 tours de spire sur elle-même. Les acides aminés qui forment alors les liaisons hydrogènes sont dans un même sens.
Les chaînes polypeptidiques peuvent soit former uniquement des hélices alpha, soit uniquement des feuillets bêta plissés ; mais on peut aussi avoir une association de ces deux types d'organisation, ce dernier cas est le plus fréquent.
La pathogénicité du prion (protéine responsable de la maladie de Creutzfeldt-Jakob) est due à la transformation d'une hélice alpha en feuillet bêta.- Portail de la biochimie
Catégorie : Protéine
Wikimedia Foundation. 2010.