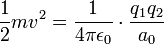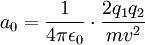- Expérience De Rutherford
-
Expérience de Rutherford
L'expérience de Rutherford, menée en 1909 par Hans Geiger et Ernest Marsden sous la direction d'Ernest Rutherford, montra que la partie chargée positivement de la matière (maintenant appelée noyau atomique) est concentrée en un espace de petit volume.
Antérieurement à cette expérience, la matière était conçue sous la forme d'atome contenant deux parties chargées électriquement de façons opposées, la partie chargée négativement pouvant être arrachée à l'atome (rayons cathodiques). L'atome était représenté comme un « pudding aux raisins » plum pudding : une « pâte » positive avec des inclusions négatives (modèle de Thomson). L'expérience de Rutherford montra qu'en réalité le noyau chargé positivement est de taille très petite devant le nuage électronique qui l'entoure, chargé négativement.
Sommaire
Observation
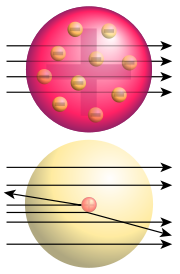 Haut : particules passant à travers le modèle de Thomson
Haut : particules passant à travers le modèle de Thomson
Bas : particules diffusées par le modèle de RutherfordL'expérience est réalisée sous vide. De la matière radioactive émettant des particules α (noyaux d'hélium, He2+) est placé dans une boite et le faisceau de particule α est orienté en direction d'une fine feuille d'or (6000Å). Derrière cette couche d'or, un écran est placé ; il est enrichi d'une substance chimique (Sulfure de zinc: ZnS) permettant de visualiser, par un scintillement lumineux, la collision par les particules α.
Plusieurs minutes après la disposition du matériel, différents points lumineux apparaissent sur l'écran et ces points ne sont pas dans l'orientation du faisceau, mais étalés sur de grands angles
Interprétation
La majorité des particules α traversent la feuille d'or, sans être déviées mais une partie de ces particules , de l'ordre de 0,01 %, a été déviée. De cette expérience, nous pouvons déduire que la matière est une structure lacunaire. Elle est constituée essentiellement de vide c'est pour cela que la plupart des particules ne sont pas déviées. Il existe de même des îlots de charge positive qui repoussent les particules α. L'ordre de grandeur de ces îlots est infiniment petit par rapport à l'atome.
En fait, Rutherford a observé la diffusion inélastique en pensant que c'était la diffusion élastique. Le taux de diffusion élastique est supprimé par un facteur de forme qui prend en compte le mouvement du noyau comme un nuage positif (ou bien « pâte »). En plus, la transmission de l'énergie aux "noyaux" liés excite les atomes (diffusion inélastique). Seulement la somme de tous les différents événements (avec participation des voisins donc) crée l'image d'un noyau ponctuel (cf. Discussion).
Implications
Suite à cette expérience, Ernest Rutherford proposa un modèle « planétaire » de l'atome : les électrons, portant les charges négatives, étaient satellisés autour d'un noyau positif très petit. Ce modèle fut battu en brèche par deux considérations :
- les lois de l'électromagnétisme, et notamment les équations de Maxwell, qui montraient qu'un électron tournant devait rayonner de l'énergie et donc ralentir au point de s'écraser sur le noyau ;
- le fait que les interactions entre les rayonnements électromagnétiques étaient quantifiées (voir Corps noir et Effet photoélectrique).
Estimation de la taille d'un noyau
L'expérience de Rutherford permet d'estimer la taille de l'atome en mesurant l'énergie des particules ayant rebondi sur le noyau, c'est-à-dire ayant été diffusées avec un angle de 180°. Ce sont ces particules qui s'approchent le plus possible du noyau. La conservation de l'énergie dit que :
où a0 est l'estimation de la taille du noyau, ou bien la distance minimale d'approche du noyau.
Il est alors possible d'en déduire a0 :
Dans l'expérience de Rutherford, les valeurs sont :
- la masse m = 6.7×10−27 kg,
- la charge d'une particule alpha q1 = 2×(1.6×10−19) C,
- la charge d'un noyau d'or q2 = 79×(1.6×10−19) C
- la vitesse initiale des particules alpha v = 2×107 m/s
Le calcul donne une estimation de 2.7×10−14 m pour la taille d'un noyau d'or.
Voir aussi
Liens internes
Références
- (en) H. Geiger and E. Marsden, On a Diffuse Reflection of the α-Particles, Compte rendu de la Royal Society, 1909 A vol. 82, p. 495-500
- Portail de la physique
Catégories : Atome | Expérience de physique
Wikimedia Foundation. 2010.