- Coloration de Gram
-
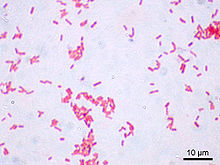
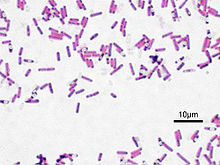
La coloration de Gram doit son nom au bactériologiste danois Hans Christian Gram qui mit au point le protocole en 1884. C'est une coloration qui permet de mettre en évidence les propriétés de la paroi bactérienne, et d'utiliser ces propriétés pour les distinguer et les classifier. Son avantage est de donner une information rapide sur les bactéries présentes dans un produit ou un milieu tant sur le type que sur la forme.
Sommaire
Méthodologie
Réalisation du frottis
Elle nécessite d'avoir un frottis fixé, soit
- par l'alcool durant 5 minutes (et rinçage à l'eau),
- plus classiquement en effectuant une fixation simple à l'eau et à la flamme selon les indications suivantes : sur une lame, déposer une goutte d'eau stérile. Ajouter à l'anse de platine stérilisée une goutte de la colonie isolée. Étaler et fixer à la chaleur à environ 40°C pendant 10 à 15 minutes. Poser la lame séchée sur le portoir reposant sur un bac de coloration.
Réalisation de la coloration
Voici succinctement les différentes étapes de cette coloration :
- Coloration par le violet de gentiane ou cristal violet. Laisser agir de 30 secondes à 1 minute. Rincer à l'eau déminéralisée.
- Mordançage au lugol (solution d'iode iodo-iodurée): étaler le lugol et laisser agir 20 secondes ; Rincer à l'eau déminéralisée. On peut réaliser une deuxième fois l'opération identiquement pour plus de sécurité.
- Décoloration (rapide) à l'alcool (+acétone): verser goutte à goutte l'alcool ou un mélange alcool-acétone sur la lame inclinée obliquement, et surveiller la décoloration (5 à 10 secondes). Le filet doit être clair à la fin de la décoloration. Rincer sous un filet d'eau déminéralisée ;
- Recoloration à la safranine ou à la fuchsine. Laisser agir de 30 secondes à 1 minute. Laver doucement à l'eau déminéralisée. Sécher la lame sur une platine chauffante à 40°C, 10 à 15 minutes.
- Observer avec une goutte d'huile à immersion objectif 100 (grossissement ×1000).
Les étapes 1 et 2 colorent en violet le contenu de la bactérie. Le violet de gentiane se fixe sur les composants cytoplasmiques de toutes les bactéries. Le lugol permet de fixer cette coloration interne.
L'étape 3 (alcool) sert à décolorer le cytoplasme des bactéries qui seront dites « Gram négatives ». En effet, celles-ci ont une paroi pauvre en peptidoglycanes - donc plus fine - qui va laisser passer l'alcool (molécule hydrophile) ou le mélange alcool-acétone, et qui décolorera le cytoplasme en éliminant le violet de gentiane. Au contraire, pour les bactéries dites « Gram positif » la paroi constitue une barrière imperméable à l'alcool car elle est composée d'une « couche » de peptidoglycanes plus importante donc de ce fait ; plus épaisse. Elles resteront alors violettes.
L'étape 4 est une contre-coloration ayant pour but de donner aux bactéries Gram négatives précédemment décolorées une teinte rose permettant de les visualiser au microscope. Les bactéries à Gram positif restées violettes seront évidemment insensibles à cette contre-coloration plus pâle que le violet imprégnant leur cytoplasme. la coloration de Gram permet de différencier la paroi bactérienne et de scinder les bactéries en deux grand groupes:
- Gram+ qui ont une paroi de peptidoglycanes épaisse (ex : Bacillus cereus)
- Gram- qui ont une paroi de peptidoglycanes fine, mais ont en plus une membrane externe lipidique (ex : Escherichia coli).
Ces différences de coloration et les différences de formes (bacille ou cocci) sont à l'origine de la classification des bactéries.
Nota : Certaines bactéries restent insensibles à cette coloration, c'est le cas, entre autres, des Mollicutes, ou appelés Ténéricutes, l'une des trois grandes classes d'Eubactéries (Gracilicutes, Firmicutes, Ténéricutes). En effet, ces bactéries sont dépourvues de membrane externe (et donc devraient être des Gram +) mais elles apparaissent Gram - car elles sont également dépourvues de paroi.
Variante
Gram KOH
Le but de cette méthode est de déterminer rapidement si une bactérie est gram positive ou négative sans passer par les étapes de coloration habituelles et sans utiliser un microscope. Il suffit juste de mettre en contact (sur une lame pour microscope) une colonie isolée avec une goutte d'une solution de KOH 3 %. À l'aide d'une pipette Pasteur, on mélange. Quelques secondes après, on tire le mélange vers le haut, si un filament se forme entre le pipette et la lame, alors la colonie isolée est constituée de bactérie gram négative. Si rien n'est entraîné par la pipette, on a affaire à des bactéries gram positive.
Les études de John Buck en 1982 montre que tous les résultats obtenus par cette méthode ont été confirmés par la coloration de Gram.
Articles connexes
Catégories :- Bactériologie
- Biologie médicale
- Coloration histologique
Wikimedia Foundation. 2010.