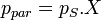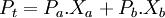- Colligativité
-
Propriété colligative
Les propriétés colligatives des solutions chimiques sont des propriétés qui dépendent uniquement du nombre et non de la nature des particules de solutés dans une solution.
Les propriétés colligatives peuvent être employées pour la détermination de masses moléculaires.
exemples:
1ère loi (Sous cette forme valable pour un solvant volatil avec un corps solubilisé non volatil)
2e loi (lorsque le solvant et le soluté sont volatils):
où Pt: pression total Pa: pression du solvant pur Xa: fraction molaire du solvant Pb: pression du soluté pur Xb: fraction molaire du soluté
On peut montrer facilement que la diminution de la tension de vapeur entraine aussi une augmentation du point d'ébullition et une diminution du point de fusion:
- Augmentation du point d'ébullition: DTb = Kb(X)•b(Y)•i
Kb(X) est la constante ébullioscopique du solvant X, b la molarité de la substance dissoute Y et i est le coefficient de Van't Hoff. Diminution du point de fusion : DTc = Kc(X)•b(Y)•i Kc(X) est la constante cryoscopique.
- Abaissement du point de congélation
Voir aussi
- Portail de la chimie
Catégories : Chimie physique | Propriété chimique
Wikimedia Foundation. 2010.