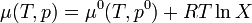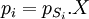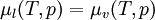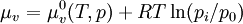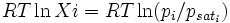- Loi De Raoult
-
Loi de Raoult
La loi de Raoult a été définie par François-Marie Raoult.
La loi de Raoult est la suivante :
La pression de vapeur d'une solution idéale est dépendante de la pression partielle de chaque constituant et de leurs fractions molaires respectives.
Considérons une solution liquide.La solution considérée obéit à la loi de Raoult si chaque constituant de la solution vérifie les deux relations équivalentes suivantes :
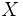 fraction molaire du constituant considéré
fraction molaire du constituant considéré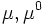 potentiel chimique
potentiel chimique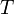 température
température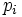 pression partielle
pression partielle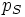 pression de vapeur saturante
pression de vapeur saturante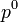 pression de référence, en général 1atm.
pression de référence, en général 1atm.
Démonstration de la Loi de Raoult
Dans une solution à l'équilibre, les potentiels chimiques de la phase liquide et de la phase vapeur sont égaux :
Pour une solution comprenant plusieurs solutés :
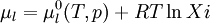
On a donc la relation : :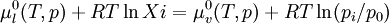 (1)
(1)
Pour une solution comprenant un seul soluté :
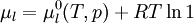
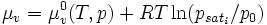
On a donc la relation : :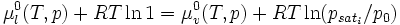 (2)
(2)
Par différence de (1) et (2), on déduit :
soit :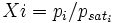
donc :
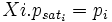
Remarque sur la loi de Henry, apparentée à la loi de Raoult
La loi de Henry établit une relation entre la pression partielle pi d'un corps pur gazeux et sa fraction molaire
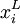 dans un solvant :
dans un solvant :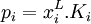
Cette loi mesure la solubilité d'un gaz dans un solvant liquide avec lequel ce gaz est en contact.
Ki est une constante de la loi de Henry spécifique du gaz donné
Attention
Cette loi de Henry ne doit pas être confondue avec la loi de Raoult. La loi de Raoult établit un lien entre la pression partielle d'un corps pur gazeux en équilibre avec une solution qui contient également ce corps pur à l'état liquide dans une proportion importante. Dans la loi de Raoult, il n'y a pas de solvant à proprement parler : les deux corps purs du mélange sont dans des proportions de même ordre de grandeur.
Voir aussi
- Portail de la physique
Catégories : Loi en thermodynamique | Loi en chimie | Solution
Wikimedia Foundation. 2010.