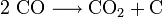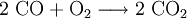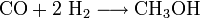- 630-08-0
-
Monoxyde de carbone
Monoxyde de carbone 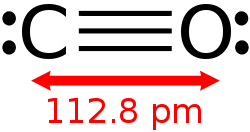
Général No CAS Apparence gaz comprimé incolore, inodore, insipide.[1] Propriétés chimiques Formule brute CO [Isomères] Masse molaire 28,0101 g∙mol-1
C 42,88 %, O 57,12 %,Propriétés physiques T° fusion -205 °C[1] T° ébullition -191 °C[1] Solubilité dans l'eau à 20 °C : 2.3 ml/100 ml[1] Masse volumique 1,145 (gaz à 298K) T° d’auto-inflammation 605 °C[1] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air en volume % dans l'air : 12.5-74.2[1] Thermochimie S0gaz, 1 bar -110,53 kJ/mol Précautions Directive 67/548/EEC 
T
F+Phrases R : 12, 23, 48/23, 61, Phrases S : 45, 53, Transport - 1016 SIMDUT[2] 


SGH[3] 



DangerInhalation Très dangereuse, mortelle Ingestion Cause possible de nausée et vomissements Unités du SI & CNTP, sauf indication contraire. Le monoxyde de carbone est un des oxydes du carbone. La formule chimique s'écrit CO, la molécule est composée d'un atome de carbone et d'un atome d'oxygène. Ce corps composé est à l'état gazeux dans les conditions normales de pression et de température.
Le monoxyde de carbone a été et reste un gaz industriel. Rappelons que le monoxyde de carbone CO participe à la combustion : les fours à gazogène à la fin du dix-neuvième siècle, du type générateurs Siemens, le brûlent essentiellement. Il reste un grand combustible, un agent réducteur ou d’addition industriel.
Le monoxyde de carbone est incolore, inodore et très toxique pour les mammifères. Il est la cause d’intoxications domestiques extrêmement fréquentes, parfois mortelles en cas d'absence de détection ou de survenue brutale dans l'air respirable de l'homme [4].
Son émanation provient fréquemment d'un chauffage déréglé. Le mélange avec l’air est facile puisque sa densité est proche de celle de l’air[5]. Ce gaz ici indésirable résulte de la combustion de matière carbonée dans des conditions spécifiques de combustion incomplète. L'oxygénation du foyer reste insuffisante pour brûler complètement les gaz formés à partir de la matière, mais la réaction est assez exothermique pour élever et maintenir la température au delà de 950 °C. Le monoxyde de carbone se forme alors préférentiellement au dioxyde de carbone, selon l'équilibre de Boudouard. En dessous de ce seuil, la molécule CO est métastable, a fortiori à température et pression ambiantes. Elle se décompose toutefois très lentement, et surtout au contact de surfaces pour former du dioxyde de carbone et du carbone. C'est selon cette réaction réversible que le carbone est transporté au cœur des procédés sidérurgiques ou, plus surprenant, au cœur de mécanismes biochimiques in vivo.
Sommaire
Chimie
Les orbitales moléculaires qui décrivent la structure du monoxyde de carbone sont semblables à celle du diazote N2. Les deux molécules ont chacune douze électrons et quasiment la même masse molaire. Il faut toutefois tenir compte de l'électronégativité plus importante de l'atome d'oxygène. La molécule présente un moment dipolaire avec une légère charge partielle positive sur le carbone. La distance interatomique de 0,112 nm correspond plutôt à une triple liaison.
Propriétés chimiques
CO est un gaz incolore et inodore à température et pression normales, très peu soluble dans l'eau. Ses points d'ébullition et de fusion, et surtout sa densité gazeuse sont proches de ceux de l'azote moléculaire. Mais l'asymétrie d'électronégativité explique qu'il est beaucoup plus réactif que l'azote et joue un rôle de ligand dans des complexes métalliques. Sa toxicité, présentée dans une partie spécialisée ci-dessous, ou sa métastabilité en dessous de 950 °C en sont une preuve.
Le premier sens de l'équation réversible de Boudouart est une réaction de décomposition chimique.
avec une variation d'enthalpie libre de 39 kcal/mol. La cinétique de cette réaction réversible est favorisée par des surfaces de métaux et d'oxydes métalliques, par exemple le fer et ses oxydes. Si la réaction a lieu avec une cinétique suffisante, elle est à moitié réalisée vers 700 °C, complète en dessous de 400 °C.
Le gaz CO est absorbé par une solution saturée de chlorure cuivreux dans HCl. Ce précipité, composé d'addition sous forme de cristaux blancs permettait avec l'appareil Orsat de doser de manière volumétrique le CO parmi d'autres gaz. L'analyse de ce gaz industriel, combustible, était commune bien avant 1880.
Combustion et vieux usages industriels
Le monoxyde carbone réagit avec le dioxygène pour former du dioxyde de carbone suivant la réaction exothermique
avec une variation d'enthalpie libre de -67,5 kcal/mol. C'est pourquoi il était préparé en quantité considérable dans le gazogène de type Siemens. Ce gaz à l'air combustible est simplement le produit d'une première combustion incomplète de couche de charbon.
La pyrolyse de la houille donne aussi un gaz qui en contient environ un dixième en masse (gaz de houille, autrefois servant à l'éclairage ou gaz de cokerie). En termes de la pyrolyse (ce qui était interdit dans la législation française sur le gaz d'éclairage) ou sur un charbon porté au rouge, la projection d'eau ou de vapeur d'eau permet d'obtenir le gaz à l'eau, encore appelé après purification gaz de synthèse.
Cette réduction de la vapeur d'eau est conduite à 500 °C, catalysée sur un lit de Fe2O3 et d'oxydes métalliques. Cette réaction autrefois commune en carbochimie est endothermique, avec une variation d'enthalpie libre de 10 kcal/mol.
Le monoxyde de carbone est le gaz réducteur des divers oxydes métalliques. Il se forme en traversant les couches de charbon de bois des bas fourneaux antiques et des hauts fourneaux communs à partir du quatorzième siècle. Les métallurgistes, et en particulier les sidérurgistes de l'Antiquité ou du Moyen âge, soupçonnent l'existence d'un corps subtil qui réduit les minerais finement triés et concassés.
Réduction du CO par le dihydrogène H2
Suivant les catalyseurs employés, les stœchiométries et les conditions des phases gazeuses, une gamme de molécules organiques ou, en présence de métaux réactifs, de carbures métalliques a été obtenue au tournant du vingtième siècle. Les chimistes allemands et français ont été les précurseurs.
Senderens et Sabatier en 1902 proposent le nickel à 240 °C sous 1 atm.
Si on augmente la pression au delà de 100 atm et si on adapte la catalyse, la synthèse de combustibles liquides, sous forme d'hydrocarbures, ou encore d'alcènes, d'alcools, de glycols ou de cétones est réalisable.
La synthèse du méthanol, une des plus importantes matières premières industrielles de synthèse, illustre ce type de procédé :
A une pression d'environ 300 atm, T = 370 °C, l'emploi de catalyseurs à base de ZnO, Cr2O3 permet d'obtenir un méthanol très pur.
Un autre possibilité de catalyse à P # 50 bars, T = 250 °C avec CuO, ZnO, Al2 O3 est encore commune pour obtenir un méthanol.
On peut produire de l'acide acétique en faisant réagir du monoxyde de carbone et du méthanol avec une catalyse homogène de rhodium (procédé Monsanto).
Réaction d'addition
L'addition du CO en présence d'hydrogène avec les alcènes, appelée hydroformylation, permet la synthèse industrielle des aldéhydes.
oléfine monosubstituée + CO2 + H2 -> mélange d'aldéhydes puis par réduction d'alcool primaire L'action catalytique de Co(CO)4, à P # 120 bars, T = 80 °C, permet de fixer CO sur la chaîne carbonée. Les proportions de racémiques sont fonction de la facilité d'accès au site électrophile. De façon prépondérante, la chaîne est allongée plutôt que ramifiée.
Une réaction conduite en présence d'eau donne des acides carboxyliques. S'ils sont produits en même temps que des cétones, réduites en alcools, des équilibres d'estérification favorisent un mélange complexe avec des esters.
Le procédé Aldox permet à partir de l'alpha-oléfine, propène, et de gaz de synthèse une première réaction OXO. Après aldolisation avec la soude NaOH, puis une crotonisation à l'aide d'un acide, et enfin une hydrogénation sur Ni, des alcools primaires en C6-C9 peuvent servir de plastifiants sous forme d'ester.
Outre les alcènes ou oléfines, CO s'additionne aussi à l'oxygène (combustion), au halogène ou au cyanogène, au soufre ou à la soude.
Composés d'addition avec des métaux de transition : les métaux carbonyles
Avec le nickel Ni et le fer Fe, comme avec les autres métaux de transition du groupe VI, VII et VIII, le monoxyde de carbone forme des composés d'addition. La structure de ces complexes a été élucidée par les travaux pionniers d'Alfred Werner. Le monoxyde de nickel Ni(CO)4 est un composé volatile découvert en 1888 par Mond, Langer et Quincke qui a permis de purifier le nickel du Cobalt. Ce composé (cancérigène) se décompose immédiatement en monoxyde de carbone et nickel ce qui permet la purification du nickel. L'emploi de monoxyde de carbone sous forte pression a permis de découvrir une multitude d'autres métaux carbonyles entre 1890 et 1910, parmi lesquels le Co(CO)4 utilisé ci-dessous comme catalyseur de la synthèse OXO. Ces transporteurs d'oxyde de carbone sur les molécules organiques, communément usités dès 1940 et appelés carbonyles métalliques, donneront cours à une intense littérature de brevets dans les années 1950. Fernand Gallais a apporté une meilleure compréhension physico-chimique de ce domaine désormais établi de la chimie de coordinations.
Intoxication au monoxyde de carbone
Article détaillé : Intoxication au monoxyde de carbone.L’intoxication par le monoxyde de carbone représente en France 6 000 à 8 000 cas par an dont 90 (en 2006[6]) à 300 décès[7]. C'est la première cause de décès par intoxication en France. En revanche la mortalité hospitalière est inférieure à 1%.
Ses causes sont le plus souvent accidentelles, par mauvais fonctionnement ou mauvaise utilisation de moyens de chauffage ou de moteurs thermiques.
Les signes cliniques les plus fréquents sont des céphalées (environ 80 % des cas), des vertiges (75 % des cas), nausées (51 % des cas). Le malaise est aussi fréquent. L’asthénie, l’impotence musculaire surtout des membres inférieurs sont aussi classiques.
Une exposition plus importante provoque des signes neurologiques et sensoriels : excitation, agitation, ataxie, confusion, et plus graves, perte de connaissance (16 % des cas) et coma (3 à 13 % des cas).
Notes et références
- ↑ a , b , c , d , e , f et g MONOXYDE DE CARBONE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Monoxyde de carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Page officielle du ministère français de la santé sur le monoxyde de carbone
- ↑ L’air a une masse molaire moyenne de 29 g/mol, le CO une masse molaire de 28 g/mol. Le dioxyde de carbone CO2 (44 g/mol), par ailleurs moins toxique et non combustible, a tendance à s’accumuler au niveau du sol dans les lieux calmes.
- ↑ Article de la Dépêche du Midi sur une intoxication à Saliès dans le Tarn
- ↑ méthodologie du Baromètre français Santé-Environnement
Voir aussi
Articles connexes
Liens externes
- Les intoxications au monoxyde de carbone (ministère français de la Santé)
- L'intoxication au monoxyde de carbone — Un diagnostic pas toujours facile à poser! (Direction de la Santé publique de Montréal)
- Portail de la chimie
- Portail de l’automobile
Catégories : Produit chimique toxique | Produit chimique extrêmement inflammable | Produit chimique reprotoxique | Oxyde | Gaz inorganique | Composé du carbone | Gaz toxique | Pollution de l'air -
Wikimedia Foundation. 2010.