- Méthode Holstein-Herring
-
La méthode Holstein-Herring[1],[2],[3],[4], aussi appelée la méthode d'intégrale de surface[5],[6], aussi appelée la méthode de Smirnov (ou Chibisov)[7] est une méthode fiable pour calculer l'énergie d'échange d'états moléculaires dont les énergies convergent asymptotiquement vers la même valeur. Quoique l'énergie d'échange devient difficile à calculer pour les grandes distances internucléaires, elle est d'une importance fondamentale dans les théories des liens moléculaires et de magnétisme. Cette énergie résulte de l'échange de noyaux identiques (Principe d'exclusion de Pauli).
Sommaire
Théorie
Pour illustrer l'idée de base de la méthode de Holstein et Herring, il est utile de se servir de l'ion moléculaire d'hydrogène et plus généralement les systèmes "atome-ion", c'est-à-dire des systèmes de liaison à un électron. Nous considérons seulement les états quantiques représentés par des fonctions paires ou impaires par rapport à l'inversion de l'espace. Ces états sont dénotés par les suffixes "g" et "u" provenant de l'allemand gerade et ungerade selon une pratique courante pour la désignation des états électroniques des molécules diatomiques. Par contre, pour les états atomiques, on se sert directement des termes pair ou impair. On peut écrire l'équation de Schrödinger selon:
où E est l'énergie (électronique) d'un état quantique quelconque, où la fonction de l'état électronique (fonction d'onde)
 dépend des coordonnées spatiales de l'électron et V est le potentiel Coulombien attractif entre l'électron et les centres nucléaires. Pour l'ion moléculaire d'hydrogène, ce potentiel est :
dépend des coordonnées spatiales de l'électron et V est le potentiel Coulombien attractif entre l'électron et les centres nucléaires. Pour l'ion moléculaire d'hydrogène, ce potentiel est :Pour tout état gerade (ou pair), l'équation de Schrödinger peut être écrite en unités atomiques (
 ) selon:
) selon:et pour tout état ungerade (ou impair), la fonction d'onde correspondante selon:
Pour simplifier, nous faisons l'hypothèse de fonctions réelles (quoique le résultat final peut être généralisé dans le domaine complexe). Nous multiplions l'équation de la fonction d'onde gerade par ψ − par la gauche et l'équation de la fonction d'onde ungerade par la gauche par ψ + et faisons la soustraction de ces résultats pour obtenir :
ou ΔE = E − − E + est l'énergie d'échange. Sans perte de généralité, nous introduisons maintenant la définition de fonctions orthogonales d'une seule particule,
 et
et  , localisées sur chaque noyau:
, localisées sur chaque noyau:Cet approche ressemble la méthode CLOA (combinaison linéaire d'orbitales atomiques) souvent utilisée en chimie quantique, mais nous devons ne pas oublier que ces fonctions
 et
et  sont polarisées en général ; il ne s'agit pas purement des fonctions propres du moment angulaire par rapport à un noyau, (voyez aussi ci-bas). Notez cependant que dans la limite
sont polarisées en général ; il ne s'agit pas purement des fonctions propres du moment angulaire par rapport à un noyau, (voyez aussi ci-bas). Notez cependant que dans la limite  , ces fonctions localisées
, ces fonctions localisées  convergent vers les fonctions (hydrogéniques) atomiques bien connues
convergent vers les fonctions (hydrogéniques) atomiques bien connues  . Nous notons M le plan de symétrie situé exactement entre les deux noyaux (voyez le dessin montré dans l'article de l'ion moléculaire d'hydrogène pour de plus amples détails), avec
. Nous notons M le plan de symétrie situé exactement entre les deux noyaux (voyez le dessin montré dans l'article de l'ion moléculaire d'hydrogène pour de plus amples détails), avec  représentant le vecteur unité normal au plan (qui est parallèle à la direction du z Cartésien), de telle sorte que l'espace
représentant le vecteur unité normal au plan (qui est parallèle à la direction du z Cartésien), de telle sorte que l'espace  entier est divisé entre les moitiés de gauche (L) et de droite (R). Par une analyse de la symétrie:
entier est divisé entre les moitiés de gauche (L) et de droite (R). Par une analyse de la symétrie:Ceci implique que:
De plus, ces fonctions localisées sont normalisées, qui nous permet de conclure que:
et réciproquement. L'intégration de ce résultat dans tout l'espace à gauche du plan produit:
et
Par une variation[Quoi ?] du théorème de flux-divergence appliquée sur le résultat ci-dessus, nous obtenons finalement :
où
 est un élément de surface différentiel dans le plan. Nous avons obtenu la formule de Holstein et Herring. Par ce dernier, Herring fut le premier à montrer[3] que le premier terme du développement asymptotique de la différence d'énergie des deux états les plus bas, c'est-à-dire le premier état quantique excité 2pσμ et l'état fondamental 1sσg (voir le graphe pour les courbes d'énergies), était :
est un élément de surface différentiel dans le plan. Nous avons obtenu la formule de Holstein et Herring. Par ce dernier, Herring fut le premier à montrer[3] que le premier terme du développement asymptotique de la différence d'énergie des deux états les plus bas, c'est-à-dire le premier état quantique excité 2pσμ et l'état fondamental 1sσg (voir le graphe pour les courbes d'énergies), était :Des calculs antérieurs fondés sur la méthode CLOA avaient fourni une valeur fausse pour le premier coefficient de 4 / 3 au lieu de 4 / e.
Applications
Les applications de la formule de Holstein et Herring furent limitées jusqu'au années 1990 quand Tang, Toennies, et Yiu[8] avaient démontré que
 pouvait être une fonction d'onde polarisée, c'est-à-dire une fonction d'onde atomique localisée à un noyau particulier mais perturbée par l'autre noyau, et donc apparemment sans symétrie gerade ou ungerade, et cependant la formule de Holstein et Herring fournit le développement asymptotique correct des énergies d'échange. En bref, le problème de deux centres est transformé effectivement en une formule impliquant un seul centre. Avec cet réalisation, la méthode de Holstein et Herring fut ensuite appliquée avec succès à une nombre de systèmes de liaison à un électron. Plus tard, Scott et al. ont expliqué et clarifié ces résultats tout en réglant les questions subtiles mais importantes concernant la convergence de la fonction d'onde polarisée[9],[10],[11].
pouvait être une fonction d'onde polarisée, c'est-à-dire une fonction d'onde atomique localisée à un noyau particulier mais perturbée par l'autre noyau, et donc apparemment sans symétrie gerade ou ungerade, et cependant la formule de Holstein et Herring fournit le développement asymptotique correct des énergies d'échange. En bref, le problème de deux centres est transformé effectivement en une formule impliquant un seul centre. Avec cet réalisation, la méthode de Holstein et Herring fut ensuite appliquée avec succès à une nombre de systèmes de liaison à un électron. Plus tard, Scott et al. ont expliqué et clarifié ces résultats tout en réglant les questions subtiles mais importantes concernant la convergence de la fonction d'onde polarisée[9],[10],[11].La conclusion des ces résultats est qu'il est possible d'obtenir le développement correct des énergies d'échange jusqu'à un ordre quelconque avec la formule de Holstein et Herring. Cette méthode fut généralisée au cas de "deux électrons actifs" ou systèmes de "liaison de deux électrons" pour le cas de la molécule d'hydrogène pour les états discrets correspondant aux deux énergies propres les plus bas de H2[12] et plus généralement pour les systèmes moléculaires atome-atome[13].
Interprétation physique
On peut associer une image physique à la formule de Holstein et Herring. Ce dernier est interprété comme un électron voyageant sous l'effet tunnel entre les deux noyaux, et par conséquent créant un flux à travers le plan du milieu ce qui nous permet d'isoler une formule pour l'énergie d'échange. Cette énergie est donc partagée, c'est-à-dire "échangée", entre les deux centres nucléaires. À propos de l'effet tunnel, une interprétation complémentaire vient de l’œuvre "Aspects of Symmetry" (1985) par Sidney Coleman ou un "instanton" circule à proximité des chemins "classiques" dans le cadre des intégrales de chemin. Notez que l'intégrale de volume dans le dénominateur de la formule Holstein et Herring est sous-dominant en R. Par conséquent ce dénominateur est presque unité à des distances internucléaires R suffisamment grandes et donc seulement le numérateur de l'intégrale de surface suffit pour le calcul.
Notes et références
- Holstein T., "Mobilities of positive ions in their parent gases", J. Phys. Chem. 56, 832-836 (1952).
- Holstein T., Westinghouse Research Report 60-94698-3-R9, (non publie), (1955).
- Herring C., "Critique of the Heitler-London Method of Calculating Spin Couplings at Large Distances", Rev. Mod. Phys. 34, 631-645 (1962).
- Bardsley J.N., Holstein T., Junker B.R., et Sinha S., "Calculations of ion-atom interactions relating to resonant charge-transfer collisions", Phys. Rev. A 11, 1911-1920 (1975).
- T.C. Scott, M. Aubert-Frécon, D. Andrae, "Asymptotics of Quantum Mechanical Atom-Ion Systems", AAECC (Applicable Algebra in Engineering, Communication and Computing) 13, 233-255 (2002).
- Aubert-Frécon M., Scott T.C., Hadinger G., Andrae D., Grotendorst J., et Morgan III J.D., "Asymptotically exact calculation of the exchange energies of one-active-electron diatomic ions with the surface integral method", J. Phys. B: At. Mol. Opt. Phys. 37, pp. 4451-4469 (2004).
- Smirnov B.M. et Chibisov M.I., "Electron exchange and changes in the hyperfine state of colliding alkaline metal atoms" Sov. Phys. JETP 21, 624-628 (1965).
- Tang K.T., Toennies J.P., et Yiu C.L., "The exchange energy of H2+ calculated from polarization perturbation theory", J. Chem. Phys. 94, 7266-7277 (1991).
- Scott T.C., Dalgarno A. et Morgan III J.D. (1991). "Exchange Energy of H2+ Calculated from Polarization Perturbation Theory and the Holstein-Herring Method", Phys. Rev. Lett. 67: 1419-1422.
- Scott T.C., Babb J.F., Dalgarno A. et Morgan III J.D.,"Resolution of a Paradox in the Calculation of Exchange Forces for H2+, Chem. Phys. Lett. 203, 175-183 (1993).
- Scott T.C., Babb J.F., Dalgarno A. et Morgan III J.D., "The Calculation of Exchange Forces: General Results and Specific Models", J. Chem. Phys., 99,2841-2854, (1993).
- Herring C., et Flicker M.,"Asymptotic Exchange Coupling of Two Hydrogen Atoms", Phys. Rev. A, 134, 362-366 (1964).
- Scott T.C., Aubert-Frécon M., Andrae D., Grotendorst J.,Morgan III J.D. et Glasser M.L., "Exchange Energy for Two-Active-Electron Diatomic Systems Within the Surface Integral Method", AAECC, 15, 101-128 (2004).
Catégorie :- Physique moléculaire
Wikimedia Foundation. 2010.












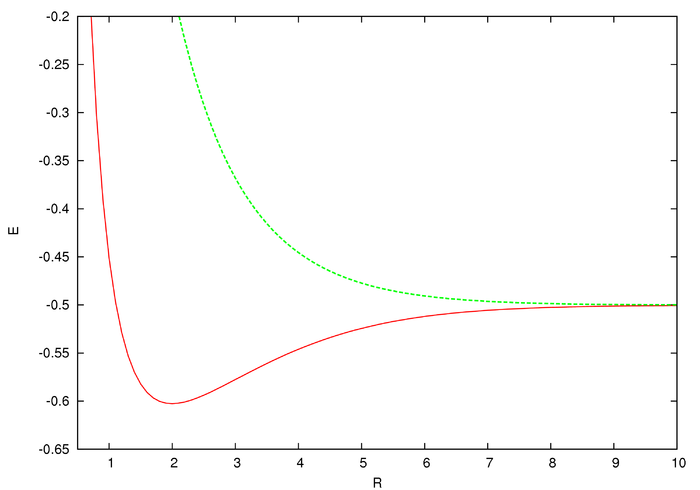
 , en fonction de la distance internucléaire (R) en unités atomiques.
, en fonction de la distance internucléaire (R) en unités atomiques.
