- Batteries de véhicules
-
Batterie au plomb
Batterie au plomb Caractéristiques Énergie/Poids 20-40[1] [2] Wh/kg Énergie/Volume 40-100[1] [2] Wh/ℓ Rendement charge-décharge 50 % Auto-décharge 5% Durée de vie min. 4 à 5 ans Nombre de cycles de charge 500 a 1200 Tension nominale par élément 2.1 V Une batterie au plomb est un ensemble d'accumulateurs au plomb-acide raccordés en série et réunis dans un même boîtier.
Ce système de stockage d'électricité est largement utilisé dans l'industrie ainsi que dans l'équipement des véhicules automobiles.
Sommaire
Historique
L'accumulateur au plomb a été inventé en 1859 par le français Gaston Planté. Il a été en effet le premier à avoir mis au point la première batterie rechargeable. À l'origine, les accumulateurs étaient situés dans des cuves en verre. Par la suite, on a systématisé l'emploi des cuves en plastique.
De nos jours, les batteries sans entretien se généralisent : cosses traitées anti-sulfatage, plaques au plomb-calcium, supprimant le besoin de refaire le niveau de liquide, et donc permettant le scellement.
Caractéristiques techniques
Une batterie au plomb se caractérise essentiellement par :
- La tension nominale qui dépend du nombre d'éléments, la tension nominale U est égale au nombre d'éléments multiplié par 2,1 V. Généralement on considère qu'un accumulateur au plomb est déchargé lorsqu'il atteint la tension de 1.8 V[réf. nécessaire] par élément, donc une batterie de 6 éléments ou 12 V est déchargée, lorsqu'elle atteint la tension de 10.8 V).
- La capacité de stockage, notée Q, représente la quantité d'énergie disponible (ne pas confondre avec la capacité électrique). Elle s'exprime en ampère-heure.
- Le courant maximal qu'elle peut fournir pendant quelques instants, ou courant de crête en ampères CCA.
Les valeurs maximales sont données par le constructeur pour une batterie neuve et chargée à 100%, elles varient sensiblement en fonction de l'état de charge, se dégradent en fonction du temps ainsi que de l'usage qui est fait de la batterie.
- Les réactions électrochimiques aux électrodes sont les suivantes :
Anode (oxydation):
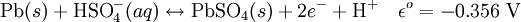
Cathode (réduction):
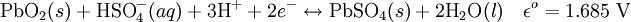
Performances
La batterie au plomb est celle qui a la plus mauvaise énergie massique 35 Wh/kg, après la batterie Nickel-Fer. Mais comme elle est capable de fournir un courant de grande intensité, utile pour le démarrage électrique des moteurs à combustion interne, elle est encore très utilisée en particulier dans les véhicules automobiles.
Utilisation
Cette batterie sert à alimenter les composants électriques des véhicules à moteur à explosion, particulièrement le démarreur électrique. Lorsque le moteur fonctionne, elle est rechargée par une dynamo ou un alternateur.
Historiquement, les batteries de voitures ou de motocyclettes faisaient le plus souvent 6 volts (3 éléments). À l'époque moderne, les batteries à 12 volts (6 éléments) sont généralisées sur les voitures et motocyclettes, alors que les véhicules lourds ou militaires utilisent le 24 volts.
Les batteries au plomb servent aussi à alimenter toutes sortes d'engins électriques. Les voitures électriques ne se sont toujours pas imposées du fait du mauvais rapport masse/énergie des batteries, bien que le rendement d'un moteur électrique soit exceptionnel.
Ces batteries peuvent servir à stocker de l'énergie produite par intermittence, comme l'énergie solaire ou éolienne.
Charge
On charge une batterie au plomb en lui appliquant un courant continu d'une valeur quelconque (sous réserve de limites technologiques liées à la batterie elle-même ou à ses connexions), pourvu qu'elle n'entraîne pas aux bornes de la batterie l'apparition d'une tension supérieure à 2,35-2,40 V/élément (valeur à 25 °C)[réf. nécessaire].
L'application de cette règle conduit à constater dans la pratique deux phases de charge successives :
- 1/ La phase dite CC (Constant Current ou Courant Constant) au cours de laquelle la tension par élément est inférieure à 2,35 V malgré l'application du courant maximum dont est capable le chargeur : le courant est déterminé par le chargeur, et la tension par la batterie. La tension aux bornes de chaque élément augmente au fur et à mesure que la batterie se recharge.
- 2/ La phase dite CV (Constant Voltage ou TC Tension Constante), dite aussi « phase d'absorption » commence dès que la tension par élément atteint la valeur de 2,35 V/élément puisque l'application de la consigne ci-dessus conduit le chargeur (son système asservi le transformant en un générateur de tension) à ajuster le courant de telle sorte que la tension reste égale à 2,35 V/élément alors que la batterie continue de se charger. Le courant au cours de cette phase est donc une fonction décroissante du temps. Il tend théoriquement vers 0 asymptotiquement.
En fin de charge le courant en phase CV ne s'annule pas. Il se stabilise à une valeur faible mais non nulle qui n'accroît plus l'état de charge mais électrolyse l'eau de l'électrolyte. On préconise donc d'interrompre la charge, ou, si l'on veut appliquer une charge permanente (dite d'entretien ou de "floating", afin de compenser le phénomène d'autodécharge), de baisser la tension de consigne à une valeur de l'ordre de 2,3 V/élément.
La charge CC/CV s'est généralisée car elle seule permet de charger à fort courant (donc rapidement) sans endommager la batterie. Ce mode de charge est utilisé dans toutes nos automobiles : en phase CC, le courant de charge dépend essentiellement de la vitesse de rotation de l'alternateur (et donc du moteur). En phase CV, la tension de consigne est maintenue par l'asservissement que constitue le régulateur de tension. Celui-ci diminue en effet le courant d'excitation de l'alternateur, de façon à ce que le courant de sortie de l'alternateur n'ait jamais pour résultat une tension supérieure à 2,35 V/élément (avec une légère correction en fonction de la température).
Lorsque dans le cas des chargeurs bon marché, on ne dispose pas d'un chargeur capable de limiter sa tension à la valeur de consigne correspondant à 2,35 V/élément, on recommande de limiter le courant de charge à par exemple 10% de la capacité de la batterie afin de minimiser les conséquences dommageables du dépassement de tension qui risque de se produire en fin de charge (ainsi que les conséquences néfastes pour la durée de vie des électrodes pendant la charge ?).Causes de dégradation
Les principales causes de dégradation des batteries sont :
- la sulfatation
- la décharge complète
- le cyclage
- l'oxydation des électrodes
- l'oxydation des bornes
La sulfatation
La sulfatation représente l'accumulation de sulfate de plomb sur les électrodes. Ce phénomène apparait naturellement à chaque décharge de la batterie, et disparait lors d'une recharge. Cependant sous certaines conditions (décharge prolongée ou trop profonde, température importante, gazéification de l'électrolyte), des ilots stables de sulfate de plomb apparaissent et ne sont plus dissous lors de la charge. Le sulfate de plomb ainsi généré diminue la capacité de la batterie en empêchant les réactions sur l'électrode et de par sa faible conductivité électrique[3].
Le processus de sulfatation est interrompu dès que la batterie est remise en charge.
Exemple : Une batterie sulfatée de 1000 CCA à l'état neuf, mais contrôlée à 12 V et avec une puissance de 500 CCA, reprendra après recharge une tension supérieure ou égale à 12,6 V mais la puissance mesurée de 500 CCA évoluera peu.
Une batterie dans cet état ne permettra pas plusieurs démarrages consécutifs d'un véhicule automobile et pourra provoquer, par exemple, une panne immobilisante dès les premiers froids. De manière générale, si le véhicule n'est pas utilisé pendant une longue période, il faut recharger sa batterie régulièrement pour la faire durer.
Désulfatation
Il existe un moyen d'inverser le processus de sulfatation d'une batterie. Cela consiste en l'envoi d'impulsions électriques à la fréquence de résonance de la batterie (entre 2 et 6 MHz). Durant ce processus, les ions de soufre entrent en collision avec les plaques, ce qui a pour effet de dissoudre le sulfate de plomb qui les recouvre[4]. Ce procédé est toutefois sujet à discussions par les spécialistes de la batterie car il n'a pas clairement démontré son efficacité sur le terrain (un peu comme les piles alcalines rechargeables).[réf. nécessaire]
La décharge complète
Pour un véhicule automobile, la décharge complète de la batterie intervient généralement par une faible consommation pendant une durée prolongée (exemple : plafonniers) ou par une consommation importante (ex feux de croisement, ventilation), moteur à l'arrêt. La tension est alors très faible aux bornes de la batterie, inférieure à 10 volts pour une batterie dont la tension nominale est de 12 V.
Une batterie de démarrage se décharge également toute seule dans le temps. Elle risque donc d'atteindre sa décharge complète si elle n'est pas rechargée régulièrement. Pour cette raison, il existe les « chargeurs d'entretien » de batteries.
La plupart des batteries neuves ne sont que préchargées. Une batterie neuve, qui n'est pas rechargée au préalable avec un chargeur adapté, peut être amenée en décharge complète si le véhicule n'est pas utilisé pour recharger la batterie (avec un nombre suffisant de kilomètres).
Exemples :
- Installation de la batterie (sans recharge), démarrage (pour test), suivi d'un long stationnement ... décharge complète.
- Installation de la batterie (sans recharge), démarrage suivi d'un nombre de kilomètres limité (la batterie n'est donc pas suffisamment rechargée), stationnement, démarrage suivi de nouveau d'un nombre de kilomètres limité ... ainsi de suite jusqu'à décharge complète.
Les batteries en état de décharge complète doivent être rechargées dans un délai maximum de 48 heures : au-delà, les dommages sont irréversibles (sauf par désulfatation)[réf. nécessaire].
Cyclage
Les constructeurs de batteries indiquent leur durée de vie sous la forme d'un nombre de cycles normalisés de décharge/recharge.
À l'issue d'un certain temps de fonctionnement dépendant du nombre et de l'amplitude des cycles, la batterie est usée : l'électrolyte présente un aspect noirâtre.
Exemple : l'utilisation répétée d'un hayon élévateur moteur à l'arrêt accélère l'usure de la batterie par cyclage.
Oxydation des électrodes
L'oxydation est une cause de dysfonctionnement des batteries. Lorsque le niveau d'électrolyte est trop bas, les plaques entrent au contact de l'air et s'oxydent. La puissance au démarrage est amputée, même si le niveau d'électrolyte est complété. Le manque d'électrolyte peut venir d'une utilisation intensive (exemple : équipements auxiliaires, etc), d'une température extérieure importante (supérieure ou égale à 30 °C) ou d'une tension de charge trop élevée.
Oxydation des bornes
Il arrive qu'une batterie dont les cosses ne sont pas assez serrées, ou qui ne sert que très peu, voie ses bornes s'oxyder, ce qui empêchera le courant de passer et donc, à terme, une décharge complète.
Voir aussi
Expérience en images: http://cm1cm2.ceyreste.free.fr/accumulateur.html
Notes
- ↑ a et b Yuasa - Spécifications électriques de la famille NP
- ↑ a et b Yuasa - Spécifications électriques de la famille SWL
- ↑ site personnel du professeur Ernest Matagne (2004)
- ↑ [pdf]Plus d'informations sur la désulfatation par impulsions électriques ainsi que des instructions pour réaliser un dispositif de désulfatage (site de l'auteur du document)
- Portail de la chimie
- Portail de l’électricité et de l’électronique
Catégories : Accumulateur | Technologie automobile
Wikimedia Foundation. 2010.

