- Électron interne
-
Électron de cœur
Cet article court présente un sujet plus amplement développé ici : Liaison chimique et Orbitale atomique.En physique ou en chimie, on introduit l'expression électron de cœur pour désigner les électrons dont on considère qu'ils sont très fortement liés à leur atome et ne contribuent pas à la liaison chimique, par opposition aux électrons de valence. Selon le contexte, l'expression peut également désigner les électrons occupant les orbitales les plus basses d'un atome.
Il n'existe pas de définition absolue de ce qu'est un électron de cœur. La distinction entre électrons de cœur et électrons de valence est dans une certaine mesure un choix arbitraire — et pas toujours pertinent — qui dépend avant tout des différentes approximations que l'on applique aux électrons dans un problème particulier.
Relation avec la classification périodique
Pour un élément situé dans un des trois premières lignes de la classification périodique, on considère généralement que les électrons de cœur sont ceux qui forment la configuration électronique du gaz noble qui le précède. Ainsi pour l'atome d'aluminium (13 électrons), la configuration électronique est la suivante :
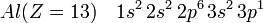
Les dix premiers électrons forment la configuration électronique du Néon. On peut réécrire la configuration électronique de l'aluminium :
![Al (Z=13) \quad [Ne]\, 3s^2\, 3p^1](/pictures/frwiki/51/3ff8d818645569dfcca498b0945ecc1a.png)
On considère donc que les dix premiers électrons sont les électrons de cœur. Les trois électrons 3s23p1 sont alors les électrons de valence.
Pour les éléments situés en dessous de la troisième ligne de la classification périodique, la distinction entre électron de cœur et de valence est délicate : l'apparition d'orbitales atomiques de type d ou f ne permet plus de distinguer les électrons de cœur des électrons de valence sur un simple critère énergétique. Cette notion perd donc beaucoup de sa pertinence pour les éléments de transition et pour les terres rares.
Articles connexes
- Portail de la physique
- Portail de la chimie
Catégories : Article court | Physique quantique
Wikimedia Foundation. 2010.
