- SCl2
-
Dichlorure de soufre
Dichlorure de soufre 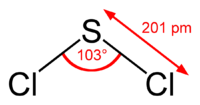
Général Nom IUPAC dichlorure de soufre No CAS No EINECS PubChem SMILES InChI Apparence liquide rouge Propriétés chimiques Formule brute SCl2 Masse molaire 102,971 g∙mol-1
Cl 68,86 %, S 31,14 %,Propriétés physiques T° ébullition 59 °C [1] Masse volumique 1,621 g∙cm-3 à 15 °C [1] T° d’auto-inflammation 230 °C [1] Point d’éclair 118 °C [1] Pression de vapeur saturante 10,1 mbar à -23 °C
217,5 mbar à 20 °C [1]Thermochimie S0gaz, 1 bar [2] S0liquide, 1 bar 183,68 J∙K-1∙mol-1 [2] ΔfH0gaz -17,57 kJ∙mol-1 [2] ΔfH0liquide -49,79 kJ∙mol-1 [2] Précautions Directive 67/548/EEC[3] 
C
NPhrases R : 14, 34, 37, 50, Phrases S : 1/2, 26, 45, 61, Transport[1] X88 1828 NFPA 704[4] Unités du SI & CNTP, sauf indication contraire. Le dichlorure de soufre est un composé soufré de formule brute SCl2. C'est un composé utilisé pour la chloration de composés organiques notamment sur les doubles liaisons[5]. Il peut former le gaz moutarde par réaction avec l'éthylène.
Sommaire
Utilisation
Ce composé chloré est principalement utilisé dans la synthèse d'additifs pour huile de lubrification. Une petite quantité sert à la production d'antioxydants, de composés organo-sulfurés et de composés en caoutchouc[5].
Propriétés physico-chimiques
Le dichlorure de soufre est instable à température et dimérise pour former du chlorure de soufre
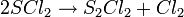
Cette réaction peut être empêchée par l'ajout de pentachlorure de phosphore ou de trichlorure de thiophosphoryle[5].
Production et synthèse
La production de dichlorure de soufre s'effectue par réaction entre du chlore gazeux avec du chlorure de soufre à basse température[5]. La purification s'effectue par distillation en présence de composés stabilisateurs.
Notes et références
- ↑ a , b , c , d , e et f Entrée de « Sulfur dichloride » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 septembre 2009 (JavaScript nécessaire)
- ↑ a , b , c et d (en) « Sulfur dichloride » sur NIST/WebBook, consulté le 14 septembre 2009
- ↑ « dichlorure de soufre » sur ESIS, consulté le 14 septembre 2009
- ↑ UCB Université du Colorado
- ↑ a , b , c et d (en) H.-D. Lauss, W. Steffens, "Sulfur halides" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 15 juin 2000
- Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique dangereux pour l'environnement | Produit chimique qui réagit avec l'eau | Composé du soufre | Chlorure
Wikimedia Foundation. 2010.


