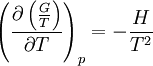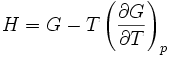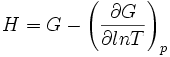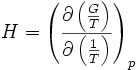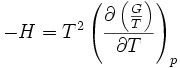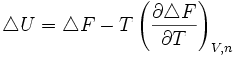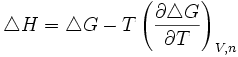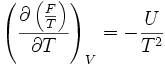- Relations d'Helmholtz
-
Relation de Gibbs-Helmholtz
La relation de Gibbs-Helmholtz (nom donné en l'honneur des physiciens Gibbs et Helmholtz) est donnée par :
Avec:
- H l'enthalpie
- G l'enthalpie libre
- T la température (absolue)
On trouve aussi d'autres formulations équivalentes de cette relation :
Sommaire
Démonstration
Cette relation se montre simplement en partant des relations de Maxwell, et en particulier celle concernant S:
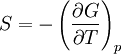
- En remplaçant dans l'expression de définition de l'enthalpie libre :
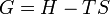
- avec ce qui précède:
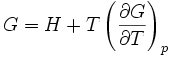
- d'où:
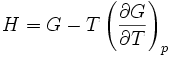
- en multipliant par
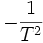 la relation précédente:
la relation précédente:
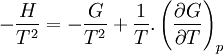
- on reconnait au 2e terme la dérivée partielle de
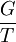 par rapport à T, à p constante:
par rapport à T, à p constante:
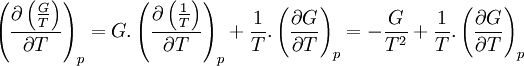
- on en déduit la relation de relation de Gibbs-Helmholtz:
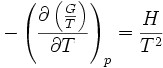
Autres formulations
On rencontre aussi les relations de Gibbs-Helmholtz sous les formes équivalentes suivantes :
Notations utilisées dans cet article
- V Volume.
- p Pression.
- T Température.
- U Énergie interne.
- H Enthalpie
- F Énergie libre.
- G Enthalpie libre.
- S Entropie
- n nombre de moles
Intérêt
Cette relation permet d'accéder facilement à l'enthalpie libre quand on connait les variations de l'enthalpie par rapport à la température à pression constante, et vice-versa. Elle fait partie des relations extrèmement utiles en thermodynamique pour passer d'un fonction d'état à une autre.
Remarque
Une relation analogue existe entre F (l'énergie libre), U (l'énergie interne), et T, même si celle-ci est beaucoup moins utilisée que la précédente:
Celle-ci se montre de la même manière, en partant de la définition de F (F=U-TS)
et de la relation de Maxwell:
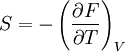
Ces formules font apparaitrent la différence entre les variations d'enthalpie et d'enthalpie libre pour la première formule et la différence entre les variations d'énergie interne et d'énergie libre pour la deuxième formule
- Portail de la physique
Catégories : Thermodynamique | Équation -
Wikimedia Foundation. 2010.