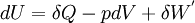- Première loi de la thermodynamique
-
Premier principe de la thermodynamique
« Rien ne se perd, rien ne se crée, tout se transforme. »Le premier principe de la thermodynamique stipule que lors de toute transformation, il y a conservation de l'énergie.
Dans le cas des systèmes thermodynamiques fermés, il s'énonce de la manière suivante :
« Au cours d'une transformation quelconque d'un système fermé, la variation de son énergie est égale à la quantité d'énergie échangée avec le milieu extérieur, sous forme de chaleur et sous forme de travail. »Sommaire
Expression dans le cas d'un système quelconque
La variation de l'énergie d'un système qui subit une transformation peut s'exprimer selon la relation suivante:
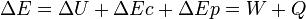
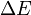 est la variation totale d'énergie du système.
est la variation totale d'énergie du système.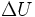 est la variation de l'énergie interne du système; c'est-à-dire son énergie propre correspondant aux énergies cinétiques et potentielles microscopiques, des particules qui le constituent.
est la variation de l'énergie interne du système; c'est-à-dire son énergie propre correspondant aux énergies cinétiques et potentielles microscopiques, des particules qui le constituent.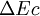 est la variation de l'énergie cinétique à l'échelle macroscopique (mouvement du système dans un référentiel donné).
est la variation de l'énergie cinétique à l'échelle macroscopique (mouvement du système dans un référentiel donné).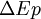 est la variation de l'énergie potentielle à l'échelle macroscopique, du système en interaction avec des champs gravitationnels ou électro-magnétiques.
est la variation de l'énergie potentielle à l'échelle macroscopique, du système en interaction avec des champs gravitationnels ou électro-magnétiques.
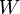 est la partie de l'énergie qui correspond au travail échangé avec le milieu extérieur. Le travail n'est pas une fonction d'état mais un mode de transfert ordonné d'énergie entre le milieu extérieur et le système.
est la partie de l'énergie qui correspond au travail échangé avec le milieu extérieur. Le travail n'est pas une fonction d'état mais un mode de transfert ordonné d'énergie entre le milieu extérieur et le système.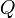 est la quantité d'énergie mise en jeu sous forme de chaleur. Elle est transmise essentiellement par trois processus d'échange thermique : conduction thermique, convection, rayonnement. La chaleur n'est pas non plus une fonction d'état mais un mode de transfert d'énergie microscopique désordonné. C'est en quelque sorte un transfert d'agitation thermique entre le système et le milieu extérieur, qui est par nature désordonné.
est la quantité d'énergie mise en jeu sous forme de chaleur. Elle est transmise essentiellement par trois processus d'échange thermique : conduction thermique, convection, rayonnement. La chaleur n'est pas non plus une fonction d'état mais un mode de transfert d'énergie microscopique désordonné. C'est en quelque sorte un transfert d'agitation thermique entre le système et le milieu extérieur, qui est par nature désordonné.
En clair cela signifie que si l'énergie d'un système varie cela veut dire qu'il y a eu un échange d'énergie entre celui-ci et le milieu extérieur sous la forme de travail ou de chaleur ou les deux à la fois.Cas des systèmes thermodynamiques
- Lorsque les systèmes sont au repos à l'échelle macroscopique, ce qui est en général le cas pour les transformations thermodynamiques affectant des systèmes physico-chimiques, les énergies cinétique
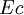 et potentielle
et potentielle 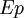 restent constantes et seule l'énergie interne
restent constantes et seule l'énergie interne 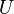 du système varie (par exemple : un réacteur chimique, un calorimètre...).
du système varie (par exemple : un réacteur chimique, un calorimètre...).
Le premier principe s'écrit alors :
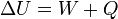
- Il existe plusieurs sortes de transfert ordonné d'énergie : travail des forces de pression,
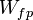 ; travail électrique fourni lors d'une réaction électrochimique de pile ou par rayonnement,
; travail électrique fourni lors d'une réaction électrochimique de pile ou par rayonnement, 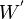 .
.
- Le travail induit par les forces de pression correspond à la forme de travail la plus courante rencontrée en thermodynamique classique, il s'exprime sous la forme différentielle suivante:
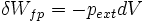
- Le signe - tient compte du fait que lors d'une détente il y a augmentation de volume ( dV > 0 ) et le système fournit dans ce cas, du travail au milieu extérieur ; travail compté négativement d'après la règle des signes.
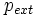 étant la pression du milieu extérieur,
étant la pression du milieu extérieur,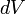 étant une variation infinitésimale de volume du système qui correspond sur un plan mathématique à la différentielle du volume.
étant une variation infinitésimale de volume du système qui correspond sur un plan mathématique à la différentielle du volume.
- Expression différentielle du premier principe
- Remarque
- Les expressions
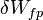 et
et 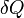 , employées pour exprimer les formes différentielles du travail et de la chaleur, signifient que ces grandeurs ne sont pas des fonctions d'état et donc que leur différentielle n'est pas exacte.
, employées pour exprimer les formes différentielles du travail et de la chaleur, signifient que ces grandeurs ne sont pas des fonctions d'état et donc que leur différentielle n'est pas exacte.
Voir aussi
Articles connexes
- Thermodynamique
- Deuxième principe de la thermodynamique
- Troisième principe de la thermodynamique
- Histoire de la thermodynamique et de la physique statistique
- Portail de la physique
- Portail de la chimie
Catégorie : Principe de la thermodynamique
Wikimedia Foundation. 2010.