- Orbite atomique
-
Orbitale atomique
 Diagrammes représentant des orbitales électroniques aux niveaux atomique et moléculaire. Le tableau à gauche présente les orbitales arrangées par niveau croissant d'énergie selon la règle de Madelung. Les orbitales électroniques de l'atome sont fonction de trois paramètres : deux angles et la distance du noyau, r. Les images à droite respectent l'angle de l'orbitale, mais ne représentent pas complètement les orbitales.
Diagrammes représentant des orbitales électroniques aux niveaux atomique et moléculaire. Le tableau à gauche présente les orbitales arrangées par niveau croissant d'énergie selon la règle de Madelung. Les orbitales électroniques de l'atome sont fonction de trois paramètres : deux angles et la distance du noyau, r. Les images à droite respectent l'angle de l'orbitale, mais ne représentent pas complètement les orbitales.
Le terme d'orbitale atomique est une notion de physique quantique, utilisée dans le modèle quantique de l'atome. Ainsi dans ce modèle, contrairement à l'ancien modèle planétaire de l'atome, on ne considère plus que les électrons d'un atome sont en orbite circulaire (ou même elliptique) autour du noyau, mais occupent de manière probabiliste certaines régions de l'espace autour du noyau. On définit alors comme orbitale atomique une zone de l'espace où la probabilité de trouver un électron autour du noyau est de 95%. Une orbitale peut ne pas être connexe.
Sommaire
Définition
Une orbitale atomique indique la probabilité de présence d'un électron autour du noyau d'un atome isolé. Elle dépend de la fonction d'onde de l'électron (et plus précisément de son module au carré), déterminée par l'équation de Schrödinger en utilisant l'approximation orbitale.
La fonction d'onde
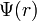 satisfait l'équation aux valeurs propres de l'hamiltonien (appelée aussi « équation de Schrödinger indépendante du temps », ou encore « équation des états stationnaires »):
satisfait l'équation aux valeurs propres de l'hamiltonien (appelée aussi « équation de Schrödinger indépendante du temps », ou encore « équation des états stationnaires »):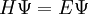
H est un opérateur appelé hamiltonien,
 est la fonction d'onde et E est l'énergie associée à cette fonction d'onde. La fonction d'onde
est la fonction d'onde et E est l'énergie associée à cette fonction d'onde. La fonction d'onde  peut être écrite soit en coordonnées cartésiennes x,y et z, soit en coordonnées sphériques r,
peut être écrite soit en coordonnées cartésiennes x,y et z, soit en coordonnées sphériques r, 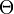 et
et 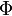 :
: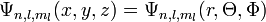
![[\Psi_{n,l,m_l}(x,y,z)]^2 dxdydz](/pictures/frwiki/101/ebd4f7c3a1aa5b605b117231b4c45a91.png) indique la probabilité de trouver l'électron dans l'élément de volume
indique la probabilité de trouver l'électron dans l'élément de volume 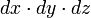 centré en
centré en 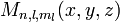
Ψ2 est la densité volumique de probabilité de présence, ou densité électronique.
Nombres quantiques
L'état d'un électron dans un atome est fonction de son énergie, ses mouvements autour du noyau, la forme de l'orbitale, défini selon 4 paramètres. Ces 4 paramètres sont les nombres quantiques.
Les indices n, l et ml sont les trois nombres quantiques décrivant une orbitale atomique de l'électron :
- n est le nombre quantique principal.
![n\in[1..\infty]\,](/pictures/frwiki/101/e1704af1f5018bf38f0e4e851ecc4dab.png)
- l est le nombre quantique secondaire (ou azimutal).
![l\in[0..n-1]\,](/pictures/frwiki/98/bc1938f71e5e719c6f2f553172f18628.png)
- ml est le nombre quantique tertiaire (ou magnétique).
![m_l\in[-l..l]\,](/pictures/frwiki/101/e779cb8dbc6725ffb5e93de30b508e63.png)
Le nombre l définit la forme et la symétrie de l'orbitale, et peut être noté en utilisant les lettres s, p, d, f :
- l = 0 correspond à l'orbitale s (sharp)
- l = 1 correspond à l'orbitale p (principal)
- l = 2 correspond à l'orbitale d (diffuse)
- l = 3 correspond à l'orbitale f (fundamental)
Le nombre quantique ms est le seul paramètre à décrire la direction de l'électron : ms positif +1/2 (sens anti-horaire) ms negatif -1/2 (sens horaire)
Table d'orbitales
Cette table montre toutes les orbitales atomiques jusqu'à 7s. Elles sont suffisantes pour caractériser tous les électrons à l'état fondamental de tous les éléments de la classification périodique jusqu'au copernicium.
s (l=0) p (l=1) d (l=2) f (l=3) n=1 
n=2 
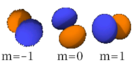
n=3 
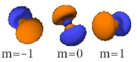
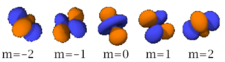
n=4 
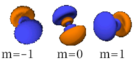
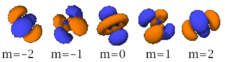
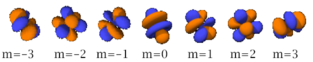
n=5 
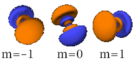
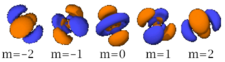
. . . n=6 
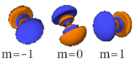
. . . . . . n=7 
. . . . . . . . . Références
Articles connexes
- Portail de la chimie
- Portail de la physique
Catégorie : Chimie quantique - n est le nombre quantique principal.
Wikimedia Foundation. 2010.
