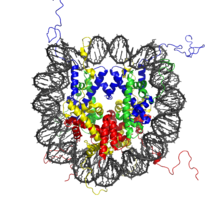
- Nucléosome
-
Le nucléosome est un complexe d’ADN et de protéines qui constitue l’unité de base de la chromatine. Il représente le premier niveau de compaction de l’ADN. En contrôlant l’accessibilité du double-brin d’ADN, il est directement impliqué dans la régulation de plusieurs processus nucléaires comme la transcription, la réplication ou la réparation de l’ADN.
Sommaire
Structure
La particule de cœur
La particule de cœur du nucléosome (ou noyau nucléosomique) est formée d’un cœur protéique de huit protéines histones (deux exemplaires de chacune des histones H2A, H2B, H3 et H4) autour duquel s’enroule environ 146 paires de bases d’ADN sur un tour trois quart. L’ensemble forme un cylindre de 11 nm de diamètre sur 5,5 nm de haut[1], pour une masse de 205 kDa (histones et ADN contribuant chacun à la moitié de cette masse)[2].
Au sein de la chromatine, les particules de cœur sont séparées les unes des autres par des segments d’ADN dit de liaison. Stricto sensu, le terme nucléosome désigne l’ensemble formé par une particule de cœur et l’ADN de liaison adjacent, mais il est fréquemment employé pour désigner uniquement la particule de cœur.
La particule de cœur constitue le premier niveau de compaction de l’ADN : les 146 paires de bases enroulées autour de l’octamère d’histones sont six fois plus compactes qu’un fragment d’ADN nu de même longueur[1].
Le chromatosome
Le chromatosome est formé par l’association d’une histone de liaison H1 à la particule de cœur[3]. L’histone H1 lie l’ADN au niveau où celui-ci rentre et sort de la particule de cœur. Elle induit le rapprochement des ADN de liaison entrant et sortant sur une trentaine de paires de bases, limitant leurs mouvements et scellant ainsi le complexe nucléo-protéique.
D’autres protéines que les histones H1 sont susceptibles de lier les ADN de liaison. Il a été proposé de les désigner collectivement « protéines de liaison », et d’étendre la définition du chromatosome pour inclure toute association d’une particule de cœur avec une protéine de liaison, qu’il s’agisse ou non d’une histone[4]. La nature de la protéine de liaison est supposée influer à la fois sur les propriétés du nucléosome et sur la capacité de la chromatine à former des structures d’ordre supérieur (comme la fibre de chromatine de 30 nm).
Le nucléofilament
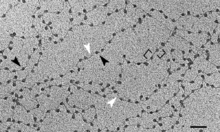 Nucléofilaments de chromatine décondensée d’érythrocytes de poulet observée au microscope électronique. L'enchaînement des particules de cœur (pointes noires) séparées par les ADN de liaison (pointes blanches) a valu à cette structure son surnom de « collier de perles ». Échelle : 50 nm.
Nucléofilaments de chromatine décondensée d’érythrocytes de poulet observée au microscope électronique. L'enchaînement des particules de cœur (pointes noires) séparées par les ADN de liaison (pointes blanches) a valu à cette structure son surnom de « collier de perles ». Échelle : 50 nm.
L’enchaînement des nucléosomes forme un nucléofilament, aussi appelé fibre de chromatine de 11 nm ou de façon imagée le « collier de perles ». Les particules de cœur y apparaissent séparés par des segments d’ADN de liaison dont la longueur varie selon les espèces et les tissus entre 25 paires de bases chez la levure bourgeonnante à 70 paires de bases dans le sperme des échinodermes[5].
Bien qu’il s’agisse de la première structure chromatinienne observée, le nucléofilament n’est néanmoins vraisemblablement qu’un artefact expérimental résultant de l’exposition de la chromatine à de faibles forces ioniques, l’enchaînement de nucléosomes n’adoptant jamais une conformation aussi étendue dans des conditions physiologiques[6].
Biochimie
Les extrémités amino-terminales des histones se projettent à l'extérieur de la partie globulaire du nucléosome et sont soumises à des modifications covalentes catalysées par des enzymes spécifiques (histone-acétyltransférase et histone-déacétylase, histone-méthylase, histone-kinase, ubiquitinase, etc.). Ces modifications pourraient agir soit en modifiant la compaction du nucléosome, soit en constituant un code signalant le recrutement spécifique de facteurs de transcription.
Les nucléosomes peuvent par ailleurs être déplacés le long du brin d'ADN sous l'action de complexes de remodelage à activité ATPasique, de type Swi2/snf2.
Le nucléosome des archées
Initialement considéré comme spécifique des eucaryotes, le nucléosome existe également chez certaines archées[7]. Des protéines homologues aux histones eucaryotes ont été identifiées chez la plupart des espèces d’Euryarchaeota. Le nucléosome archéen est formé d’un tétramère de ces histones archéennes autour duquel s’enroule un fragment d’ADN d’environ 60 paires de bases[8]. La structure de ce nucléosome tétramérique apparaît très similaire à celle du tétramère H3–H4 au cœur du nucléosome eucaryote. Il remplit les mêmes fonctions de compaction de l’ADN et de régulation de la transcription que son homologue eucaryote.
Voir aussi
Bibliographie
- (en) Jeffrey C. Hansen, « Conformational dynamics of the chromatin fiber in solution: determinants, mechanisms, and functions », dans Annu. Rev. Biophys. Biomol. Struct., vol. 31, 2002, p. 361–392 [lien PMID, lien DOI]
- (en) Joel M. Harp, B. Leif Hanson, David E. Timm et Gerard J. Bunick, « Asymmetries in the nucleosome core particle at 2.5 A resolution », dans Acta Crystallogr. D Biol. Crystallogr., vol. 56, no 12, décembre 2000, p. 1513–1534 [lien PMID]
- (en) Donald E. Olins et Ada L. Olins, « Chromatin history: our view from the bridge », dans Nat. Rev. Mol. Cell Biol., vol. 4, no 10, 2003, p. 809–814 [lien PMID, lien DOI]
- (en) John N. Reeve, Kathleen Sandman et Charles J. Daniels, « Archaeal histones, nucleosomes, and transcription initiation », dans Cell, vol. 89, no 7, 1997, p. 999–1002 [texte intégral, lien PMID]
- (en) Malcolm F. White et Stephen D. Bell, « Holding it together: chromatin in the Archaea », dans Trends Genet., vol. 18, no 12, 2002, p. 621–626 [lien PMID]
- (en) Christopher L. Woodcock, « Chromatin architecture », dans Curr. Opin. Struct. Biol., vol. 16, no 2, 2006, p. 213–220 [lien PMID, lien DOI]
- (en) Jordanka Zlatanova, Corrine Seebart et Miroslav Tomschik, « The linker-protein network: control of nucleosomal DNA accessibility », dans Trends Biochem. Sci., vol. 33, no 6, 2008, p. 247–253 [lien PMID, lien DOI]
- (en) Kensal van Holde et Jordanka Zlatanova, « The nucleosome core particle: does it have structural and physiologic relevance? », dans BioEssays, vol. 21, no 9, septembre 1999, p. 776–780 [lien PMID, lien DOI]
Articles connexes
Notes et références
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.