- Microcystine
-
La microcystine est le type de cyanotoxine le plus étudié à ce jour, et contenant plus de soixante-dix variantes[1]. Cette molécule est constituée de sept acides aminés qui se rejoignent aux extrémités pour former une structure cyclique.
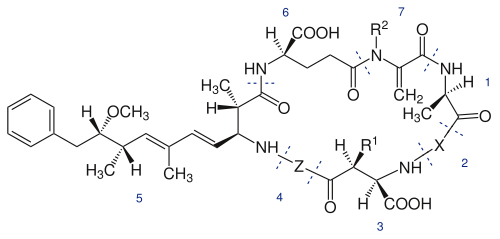
Squelette de la microcystine : 1, D-Alanine ; 2, X (variable); 3, D-MeAsp (D-érythro-b-méthyl-D-acide aspartique) ; 4, Z (variable); 5, Adda (acide (2S, 3S, 8S, 9S)-3-amino-9-méthoxy-2-6-8-triméthyl-10-phényldéca-4,6-diènoïque) ; 6, D-glutamate; 7, Mdha (N-méthyldéhydroalanine). R1 et R2 sont H (déméthylmicrocystines) ou CH3[2].
Les variantes proviennent majoritairement de substitution d’acide aminé en position 2 et 4 ou bien du retrait/ajout d’un groupement méthyle sur les fonctionnalités 3 et 7. Les acides aminés les plus communs à la position X sont la leucine (L), l’arginine (R) et la tyrosine (Y), alors qu’à la position Z on retrouve généralement l’arginine (R), l’alanine (A) et la méthionine (M)[1]. Le tableau suivant présente les différents acides aminés retrouvés à chaque position et la combinaison de ces possibilités explique le fait qu’il y ait autant de microcystines.
Variation structurelle possible à chaque position[3]. AA 1 AA 2 AA 3 AA 4 AA 5 AA 6 AA 7 D-Ala L-Leu D-MeAsp L-Arg Adda D-Glu Mdha D-Ser L-Arg D-Asp L-Aib ADMAdda D-MeGlu Dha L-Ala L-Ala DMAdda E(OMe) Dhb L-Glu L-Glu (6Z)Adda L-Ala L-GluMe L-GluMe L-MeSer L-Har L-Har L-Ser L-Hil L- Hph Mdhb L-Hph L-Hty MeLan L-Hty L-Leu L-Met L-Met L-Met(O) L-Met(O) L-Phe L-Phe L-ThTyr L-Trp L-Trp L-Tyr L-Tyr L-Val Aib = Acide Aminoisobutytique ADMAdda = O-acétyl-O-déméthylAdda Dha = Déhydroalanine Dhb = Déhydrobutyrine DMAdda = O-déméthylAdda E(OMe) = acide Glutamique méthylester Har = Homoarginine Hil = Homoisoleucine Hph = Homophénylalanine Hty = Homotyrosine MeLan = N-méthylanthionine Met(O) = Méthionine-S-oxide MeSer = N-Méthylsérine ThTyr = 1,2,3,4-tétrahydrotyrosine (6Z)Adda = Stéréo-isomère de Adda
Selon leur composition, les microcystines présentent une gamme de poids moléculaires située entre 900 - 1100 Da. Ces molécules sont très solubles dans l’eau et peu volatiles. À cause de leurs structures cycliques, elles sont très résistantes face aux conditions ambiantes et elles tolèrent différentes conditions de pH et de températures. De plus, elles peuvent rester stables pendant des années si elles ne sont pas en contact avec la lumière[4].
Toxicité
Les microcystines sont des hépatotoxines. Ces molécules sont des inhibiteurs de protéines de types phosphatases (PP1 ou PP2A) qui exécutent la déphosphorylation de phosphoprotéines intracellulaires eucaryotes. Leur inhibition entraîne un dérèglement de la structure de la cellule résultant en la nécrose de celle-ci. Une nécrose massive des hépatocytes entraîne une hémorragie interne et ultimement la mort. De plus, la phosphorylation excessive de protéines anti-tumorales, fait en sorte que les microcystines sont considérées comme des promoteurs de tumeurs[2].
La toxicité des différentes variantes de la microcystine n’est pas la même et elle serait dépendante de la méthylation de certains acides aminés. Lorsque l’entité Adda est méthylé, la toxicité de la microcystine diminue considérablement, suggérant que cette partie de la molécule est le site d’interaction majeur avec les phosphatases[5]. De plus, la forme linéaire des microcystines est reconnue pour être cent fois moins toxique[2].
Notes et références
- C. Svrcek, D.W. Smith, Cyanobacteria toxins and the current state of knowledge on water treatment options: a review, J. Environ. Eng. Sci. 3: 155-184, 2004.
- World Health Organisation (WHO), Toxic cyanobacteria in Water : A guide to their public health consequences, monitoring and management, 1ère edition, 1999.
- S. Hiller, B. Krock, A.Cembella, B. Luckas, Rapid detection of cyanobacterial toxins in precursor ion mode by liquid chromatography tandem mass spectrometry. Journal of mass spectrometry : 42 (9), 1238-1250, Sep 2007.
- Agence française de sécurité sanitaire de l’environnement et du travail (AFSSET), Évaluation des risques liés à la présence de cyanobactéries et de leurs toxines dans les eaux destinées à l’alimentation, à l’eau de baignade et aux autres activités récréatives, juillet 2006.
- L. A. Lawton, C. Edwards, Review: Purification of microcystins, Journal of Cromatography A 912: 191-209, 2001.
Wikimedia Foundation. 2010.