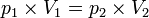- Loi de Mariotte
-
Loi de Mariotte
La loi de Boyle-Mariotte est une des lois de la thermodynamique du gaz réel. Elle relie la pression et le volume d'un gaz réel à température constante. On trace ainsi une courbe isotherme du gaz. Mariotte et Boyle ont constaté, à quelques pour cent près, que la courbe p = f(V) était proche d'une hyperbole équilatère en coordonnées dites de Clapeyron (p,V) , soit pV = constante pour une température donnée constante.
En d'autres termes, maintenir la température constante pendant une augmentation de pression d'un gaz exige une diminution de volume. Inversement, la réduction de la pression du gaz passe par une augmentation de volume. La valeur exacte de la constante n'a pas besoin d'être connue pour appliquer la loi entre deux volumes de gaz sous des pressions différentes, à la même température :
La loi a été découverte à quelques années d'intervalle par l'Irlandais Robert Boyle (en 1662) et par le Français Edme Mariotte (en 1676). Donc, certains la nomment loi de Boyle, et les plus « diplomates » l'appellent loi de Boyle-Mariotte. C'est Guillaume Amontons qui précisa en 1702 que cette loi n'est valable qu'à température constante et est plus précise aux basses pressions.
Loi universelle d'Avogadro
Si la pression est basse, le produit pV est le même, à une température donnée, quel que soit le corps pur.
Si on considère 1 mole de gaz parfait dans les conditions normales de température et de pression: R = p0V0/T0
- p0 = 1 atm = 1,01325 bar ( 1 bar = 105 Pa ),
- T0 = 273,15K,
- V0 (volume molaire) = 22,414.10-3 m3.mol-1.
On trouve R = 8,314 J.K-1.mol-1.
Applications
Le phénomène énoncé par la loi de Mariotte a des conséquences très importantes pour les plongeurs. Lors d'une plongée sous-marine, on respire de l'air comprimé. Mais, dans l'eau, la pression augmente d'un bar tous les dix mètres environ. Par conséquent, lors de la remontée, l'air qui a été comprimé va se détendre et donc augmenter son volume. Donc, si on bloque sa respiration pendant la remontée, l'air contenu dans les poumons ne pouvant pas s'échapper, il va les distendre et provoquer la rupture des tissus. Cela s'appelle la surpression pulmonaire. Il est donc important de permettre à l'air de s'échapper lors de la remontée en ne bloquant pas sa respiration.
De la même façon, les gaz dissous sous l'effet de la pression plus élevée (c'est surtout le cas pour l'azote) dans le sang et les tissus corporels vont lors de la remontée retourner à l'état gazeux, provoquant des bulles causes d'embolies. Il est donc nécessaire de respecter des paliers de décompression afin de permettre une évacuation contrôlée par expiration, de manière progressive et non brutale, des gaz et éviter ainsi une embolie gazeuse. Mais, au sens strict, ceci n'est pas une application de la Loi de Mariotte puisqu'une partie du phénomène est liée à la variation de solubilité des gaz dans un liquide selon la pression exercée.
- Portail de la physique
Catégories : Loi en thermodynamique | Théorie de la plongée
Wikimedia Foundation. 2010.