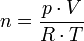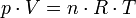- Loi d'Avogadro-Ampère
-
Loi d'Avogadro
La loi d'Avogadro, dite aussi loi des gaz parfaits, découverte par Amedeo Avogadro, énonce que des volumes égaux de gaz parfaits différents, aux mêmes conditions de température et de pression, contiennent le même nombre de molécules.
La loi peut être formulée ainsi :
- Le nombre de moles est proportionnel au volume du gaz (V).
- Le nombre de moles est proportionnel à la pression du gaz (p).
- Le nombre de moles est inversement proportionnel à la température (T).
On obtient ainsi la formule :
La forme suivante est plus connue :
R est la constante des gaz parfaits, avec R = 8,314 472 J·K-1·mol-1 ; on a en fait R = NA·kB où NA est le nombre d'Avogadro et kB est la constante de Boltzmann.
Une mole occupe approximativement un volume de 22,4 litres aux conditions normales de température et de pression (CNTP), ce qui correspond à une pression de 1 atmosphère soit 101325 Pa et une température de 0 °C, conditions à distinguer des conditions standards où la pression vaut 1 bar et la température 25 °C. Dans les conditions habituelles de température et de pression (CHTP), une mole de gaz occupe environ 24,0 litres, la pression est à 1 bar et la température à approximativement 20 °C.
Voir aussi
- Portail de la chimie
- Portail de la physique
Catégories : Loi en chimie | Loi en physique
Wikimedia Foundation. 2010.