- Liaison Δ
-
Liaison δ
Une liaison
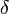 (delta) est une liaison chimique covalente où 4 lobes d'une orbitale occupée par un seul électron se recouvrent avec 4 lobes d'une autre orbitale occupée par un seul électron. Il y a exactement deux plans nodaux entre les deux atomes liés.
(delta) est une liaison chimique covalente où 4 lobes d'une orbitale occupée par un seul électron se recouvrent avec 4 lobes d'une autre orbitale occupée par un seul électron. Il y a exactement deux plans nodaux entre les deux atomes liés.La lettre
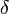 se réfère aux orbitales d, puisque la géométrie de la liaison δ est la même que celle des 4 lobes de l'orbitale d (si l'on se place dans l'axe de la liaison).
se réfère aux orbitales d, puisque la géométrie de la liaison δ est la même que celle des 4 lobes de l'orbitale d (si l'on se place dans l'axe de la liaison).En chimie, les atomes pouvant former des liaisons delta ont des orbitales d partiellement occupées : ce sont les métaux de transition. Les liaisons delta sont observées dans certains complexes de coordination contenant plusieurs atomes métalliques Certains complexes de ruthénium et de molybdène contiennent une liaison quadruple, ce que l'on peut expliquer uniquement en invoquant une liaison
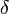 (la liaison quadruple est une liaison
(la liaison quadruple est une liaison 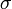 , deux liaisons
, deux liaisons 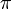 et une liaison
et une liaison 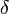 ).
).Des liaisons d'ordre plus élévé (recouvrement d'un plus grand nombre de lobes),
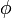 (phi) et
(phi) et 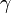 (gamma) (à comparer aux orbitales f et g) ont été prédites théoriquement, mais n'ont pas encore été observées.
(gamma) (à comparer aux orbitales f et g) ont été prédites théoriquement, mais n'ont pas encore été observées.Articles connexes
- Liaisons covalentes : liaison π, liaison σ, liaison δ, liaison osidique
- Liaison hydrogène
- Liaison ionique
- Liaison métallique
- Liaison de van der Waals
- Interaction orbitalaire
- Énergie de liaison nucléaire
- Portail de la chimie
Catégorie : Liaison chimique
Wikimedia Foundation. 2010.

