- Leishmaniose viscerale
-
Leishmaniose viscérale
 Pour les articles homonymes, voir LV.
Pour les articles homonymes, voir LV.La leishmaniose viscérale (LV), également connue sous le nom de kala-azar, ou de fièvre noire, est la forme la plus grave de leishmaniose. Il s'agit d'une maladie causée par un parasite du genre Leishmania . Parmi les parasites c'est le deuxième plus grand tueur dans le monde (après la malaria), l'un et l'autre étant responsables chacun d'un demi-million de décès estimés dans le monde entier[1].
Le parasite migre dans les viscères comme le foie, la rate et la moelle osseuse et en l’absence de traitement, aboutit presque toujours à la mort du mammifère hôte. Les symptômes comprennent la fièvre, l’amaigrissement, l’anémie, l’hépatomégalie (gros foie) et la splénomégalie (grosse rate). Selon l'organisation mondiale de la santé (OMS), il faut accorder une attention particulière au problème de l'émergence de la co-infection avec le HIV[2].
Sommaire
Espèces en cause dans la leishmaniose viscérale
Plusieurs espèces de Leishmania sont connues pour provoquer la forme viscérale de la maladie. Dans l’« ancien monde » (l’Afrique, l’Asie, l’Europe) les espèces responsables sont L.donovani et L.infantum et dans le « nouveau monde » (l’Amérique du Sud) l’espèce en cause est L.chagasi.
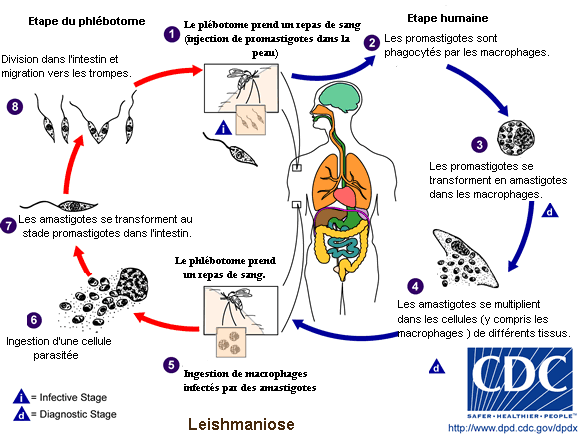
Cycle parasitaire
Cycle parasitaire des Leishmanioses. Cliquer sur l’image pour agrandir
Le Kala-azar est transmis par un insecte vecteur, le phlébotome du genre phlébotome dans l’ancien monde et le genre de Lutzomyia dans le nouveau monde. Ce sont des créatures minuscules, 2 ou 3 millimètres de long, que l'on trouve dans les régions tropicales ou tempérées du monde entier. Les larves de phlébotome se développent dans la matière organique chaude et humide, aussi les vieux troncs d’arbres, les murs de maison ou les ordures sont leurs terrains de prédilection multipliant les réservoirs ce qui les rend plus difficile à éradiquer.
Le phlébotome femelle adulte est un suceur de sang, qui s’alimente habituellement la nuit sur sa proie ensommeillée. Quand la mouche pique un homme atteint de L. donovani, le germe pathogène est ingéré avec le sang de la proie. À ce moment le protozoaire se présente sous la plus petite de ses deux formes, appelé amastigote, non mobile, ronde, de seulement trois à sept micromètres de diamètre.
Dans l'estomac du phlébotome, les amastigotes se transforment rapidement en une deuxième forme du L. donovani appelé le promastigote. Cette forme est fusiforme, sa taille est triple de celle de l'amastigote, et elle possède un simple flagelle qui lui permet d’être mobile. Les promastigotes vivent à l’extérieur des cellules dans le tube digestif du phlébotome pendant quelques jours, se reproduisent par voie asexuée puis migrent vers les glandes salivaires[citation nécessaire]. C'est pour eux un moyen d’être transmis de nouveau à un mammifère hôte, car la mouche injecte sa salive dans la proie quand elle pique. Les promastigotes sont injectés dans la circulation sanguine de la proie avec la salive de la mouche.
Une fois à l'intérieur de leur nouvel hôte, chaque promastigote s'accroche à un macrophage à l'aide de ses flagelles. Il est alors capturé vivant par la cellule sous l’action de phagocytose du macrophage. Une fois à l'intérieur, il se transforme à nouveau dans la forme la plus petite l'amastigote. Comme amastigote, L.donovani peut seulement se reproduire à l’intérieur d’une cellule et les amastigotes se multiplient dans la partie la plus hostile du macrophage, à l'intérieur des organites phagolysosome, dont ils peuvent empêcher la réponse défensive normale. Lorsqu’ils se sont reproduits jusqu’à un certain niveau, L.donovani détruit la cellule hôte sous l’effet de pression de la masse des parasites, mais il existe une hypothèse récente, selon laquelle ils peuvent quitter la cellule en déclenchant la réponse d'exocytose du macrophage.[citation nécessaire] Les cellules filles des protozoaires migrent alors par la circulation sanguine pour trouver de nouveaux macrophages hôtes. À ce moment, L.donovani provoque une infection systémique et s’étend à tous les organes de l’hôte, en particulier à la rate et au foie.
Progression de la maladie
Chez les hôtes humains, la réponse à l'infection par L. donovani varie beaucoup, non seulement dans sa force mais également dans le type de la réaction immunitaire du patient. Les patients dont les systèmes immunitaires produisent un grand nombre de Cellules T de type TH1, qui renforcent les défenses des cellules mais ne stimulent pas la formation d’anticorps, résistent souvent facilement à l'infection, et après guérison sont immunisés contre la réinfection. Les patients dont les systèmes immunitaires produisent plus de cellules de type TH2, avec une production rapide d'anticorps mais pas de réponse à type d’immunité cellulaire, sont susceptibles de succomber rapidement à la leishmaniose. Curieusement, une des grandes forces de L.donovani semble être de pouvoir contraindre l’hôte à passer d'une réponse immunitaire de type TH1 à une réponse immunitaire de type TH2 pour faciliter la progression de l'infection.
Quand un patient humain développe une leishmaniose viscérale, les symptômes les plus typiques sont la fièvre, la splénomégalie (grosse rate) et l’hépatomégalie (gros foie). La coloration noire de la peau qui a donné à la maladie son appellation courante en Inde n'apparaît pas dans la plupart des formes de la maladie, et il est très facile de confondre les autres symptômes avec ceux de la malaria. L’absence de diagnostic est dangereuse, puisqu’à défaut d’un traitement approprié le taux de mortalité du kala-azar atteint près de 100%. Cependant L.donovani lui-même n'est habituellement pas la cause directe de la mort chez les victimes du kala-azar. La Pneumonie, la tuberculose et la dysenterie sont omniprésentes dans les régions défavorisées où la leishmaniose prospère, et, comme avec le SIDA, ce sont des infections opportunistes qui sont capables de tuer, en se développant chez un hôte dont le système immunitaire a été affaibli par l'infection à L.donovani . La vitesse de progression de la maladie est extrêmement variable, s’étendant sur une durée d'une à vingt semaines, mais la durée dévolution habituelle pour la forme soudanaise de la maladie est plus courte, allant de douze à seize semaines.
Même après la guérison, kala-azar ne laisse pas toujours ses hôtes serveurs indemnes de séquelles. Quelque temps après la réussite du traitement, généralement quelques mois avec le kala-azar africain, ou plusieurs années avec la forme indienne de la maladie, peut apparaître une forme secondaire, connue sous le nom de "leishmaniose cutanée post kala-azar", ou PKDL. Cette forme se manifeste d'abord par un érythème morbilliforme (ressemblant à la rougeole) du visage, qui s’étend graduellement sur tout le corps. Par la suite les lésions peuvent confluer pour former des lésions mutilantes et œdématiées évoquant la lèpre, et pouvant parfois être responsable de cécité si elles atteignent les yeux. (Cette maladie est différente de la leishmaniose cutanée, une maladie moins grave provoquée par un autre protozoaire du genre Leishmania qui est également responsable de lésions cutanées).
Diagnostic
La méthode de choix pour le diagnostic est la mise en évidence d’amastigotes au microscope, sur le produit de la ponction splénique ou de la ponction de moelle osseuse. C'est un procédé techniquement difficile qui est rarement disponible dans les régions du monde où la leishmaniose viscérale est endémique.
Le diagnostic sérologique est beaucoup plus fréquemment utilisé dans les régions où la leishmaniose est endémique. Il est facile d’utiliser une bandelette réactive K39, et le personnel sanitaire d’un village peut être rapidement formé à son emploi. Le kit peut être stocké à température ambiante et aucun matériel supplémentaire ne doit être transporté dans des régions éloignées. Le test d'agglutination directe de l’antigène par un anticorps anti-leishmania utilisé en standard par MSF est beaucoup plus compliqué à utiliser et semble n'avoir aucun avantage par rapport au test K39. [3]
Il y a un certain nombre de problèmes avec les tests sérologiques : dans des zones de forte endémie, toutes les personnes réellement infectées ne développeront pas forcément les symptômes cliniques de la maladie et n’auront pas tous besoin de traitement. En effet, jusqu'à 32% de la population en bonne santé peut avoir un test positif, mais ne pas avoir besoin d’une prise en charge thérapeutique. [4],[5] Réciproquement, parce que les tests sérologiques recherchent une réponse immunitaire et non l'agent pathogène lui-même, le test ne devient pas négatif après la guérison du patient et il ne peut pas être utilisé pour contrôler l’efficacité du traitement, ou détecter la réinfection ou la rechute. [6] De même, les patients présentant un système immunitaire déficient (par exemple, infection par le HIV) auront des tests faussement négatifs.[7]
D'autres tests en cours de développement comportent un test d'agglutination au latex (KAtex), qui est actuellement expérimenté en Asie et en Afrique. Un autre test potentiel détecte l'acide érythrosalicylique. [6]
Traitements
Comme avec beaucoup de maladies dans les pays en voie de développement, (y compris la trypanosomiase et la malaria) on manque douloureusement de médicaments efficaces et accessibles et le parasite ou les insectes vecteurs deviennent de plus en plus résistants aux molécules anti-parasitaires existantes. Vraisemblablement en raison du manque de rentabilité, les nouvelles thérapeutiques sont longues à émerger et une grande partie de la recherche fondamentale sur les cibles potentielles des molécules a lieu dans les universités, financées par des organismes caritatifs. Cela pourrait changer en raison de l'infection des membres des forces armées des nations « développées » telles que celles qui occupent actuellement des pays comme l’Afghanistan et l’Irak, où la Leishmaniose est fréquente.
Le traitement le plus courant est l’antimoine pentavalent le stibogluconate de sodium et l’antimoniate de méglumine. La résistance à ces médicaments est maintenant fréquente en Inde [8][9] et le traitement de choix pour la leishmaniose viscérale acquise en Inde est maintenant l'Amphotéricine B[10][11][12] dans ses diverses présentations (Ambisome®, Abelcet®, Amphocil®)
- AmBisome : dose totale 21 mg/kg (LV méditerranéen/brésilien); dose totale 7,5 mg/kg pendant 6 jours (LV indien)
- Amphocil : dose totale 7,5 mg/kg pendant 6 jours (LV indien) Une dose plus faible (0.5 à 1 mg/kg) est donnée le premier jour, augmentée jusqu’à 1 à 2 mg/kg le deuxième jour, puis 1.5 à 3 mg/kg le troisième et les jours suivants.
La Miltefosine Impavido® est le premier traitement par voie orale pour cette maladie. Le taux d’efficacité de la miltefosine dans des essais cliniques la phase III est de 95% ; Des études en Éthiopie montrent qu’il est également efficace en Afrique. Chez les malades immunodéprimés atteints du HIV qui sont co-infectés avec la leishmaniose il a été prouvé que même dans les cas de résistance 2/3 des patients ont réagi positivement à ce nouveau traitement. La Miltefosine a reçu l'autorisation de mise sur le marché des autorités indiennes en 2002 et Allemandes en 2004.Il est maintenant autorisé dans de nombreux pays. La molécule est généralement mieux tolérée que d'autres substances. Les effets secondaires principaux sont les troubles gastro-intestinaux les 1 à 2 premiers jours du traitement, sans conséquence sur l'efficacité thérapeutique. Puisqu'il est disponible pour un traitement par voie orale, les dépenses et les inconvénients de l'hospitalisation sont évités, ce qui fait de lui une alternative intéressante.
L'institut pour la santé mondiale a développé la paromomycine, qui serait aussi efficace et bon marché[13]. Un traitement avec la paromomycine coûtera environ 10 dollars. À l'origine la molécule avait été découverte dans les années 1960, mais abandonnée parce qu'elle n’était pas rentable, la maladie affectant la plupart du temps des malades pauvres[1].
Histoire et épidémiologie
Le Kala-azar a attiré pour la première fois l'attention des médecins occidentaux en 1824 à Jessore, en Inde, où on a cru au départ avoir affaire à une forme de malaria. L'Inde a donné au kala-azar son nom traditionnel, qui signifie en Hindi « la fièvre noire », ainsi nommée à cause de la coloration noire de la peau qui apparaît sur les extrémités et l'abdomen et qui est l’un des symptômes de la forme indienne de la maladie. L'agent responsable de la maladie a également été isolé pour la première fois en Inde par le médecin écossais William Leishman et le médecin irlandais Charles Donovan, travaillant indépendamment l’un de l’autre. Comme ils ont publié leur découverte presque simultanément, les espèces ont été, pour deux d’entre elles nommées Leishmania donovani .
Aujourd'hui, les noms de kala-azar et de leishmaniose viscérale sont utilisés indifféremment l'un pour l'autre par la communauté scientifique pour désigner la forme plus aiguë de la maladie provoquée par L.donovani . La maladie est endémique au Bengale occidental, où on l'a découvert pour la première fois, mais elle atteint un taux de mortalité plus élevé dans le nord et l'est de l’Afrique. Elle peut également se rencontrer dans le monde Arabe et l’Europe méridionale, et une forme légèrement différente de l’agent pathogène, L.chagasi , est responsable de la leishmaniose dans le nouveau monde.
Mais, alors que la répartition géographique de la maladie est très étendue, son extension est discontinue. La maladie se concentre dans les zones de sécheresse, de famine, et à densité de population élevée. En Afrique, cela signifie qu’il existe des centres névralgiques d'infection la plupart du temps au Soudan, au Kenya, et en Somalie. Les conditions de vie y ont très peu changé depuis le siècle dernier, et les personnes ne sont normalement pas très mobiles. Des régions du Soudan, en particulier la région du Nil supérieur, sont presque totalement coupées du reste du pays, et les habitants sont comme attachés à leur lieu de naissance comme n'importe quels paysans des âges reculés en Europe.[14]
Le mode de vie contemporain s'est toutefois fait sentir même ici, non toutefois sous la forme du « progrès » mais par ces nombreuses petites guerres de l'ère post coloniale qui ont sévi en Afrique. Au Soudan, où la guerre civile a été continue depuis 1983, la violence s’est concentrée dans le sud plus peuplé, et le kala-azar s’est concentré là aussi. Mais les guerres ont généré un flux régulier de réfugiés hors de la région, et ceux-ci ont circulé à travers la frontière méridionale ou dans la partie occidentale plus reculée du pays appelée région du Nil supérieur, où la guerre et la maladie qui lui est associée n'avaient pas encore pénétré[14].
Ces réfugiés, se déplaçant à pied, ont emmené la maladie avec eux et, quand elle est arrivée, elle a frappé le Nil supérieur avec une force comparable à la variole qui avait décimé les Indiens d'Amérique. Les habitants isolés de la région du Nil supérieur n'avaient aucun accès à la médecine ni aucune information au sujet de la nouvelle maladie qui s’étendait parmi eux. Pire encore, leur système immunitaire était sans défense contre ce nouvel agent pathogène, inconnu d’eux bien qu'il fût venu d'une région proche de leur propre pays. Un village à l’épicentre de l'épidémie, Duar, n’a eu que quatre survivants seulement sur une population de mille habitants, et entre la fin des années 1980 jusqu’au milieu des années 1990, 100.000 personnes au total ont succombé à la maladie dans cette seule région. Selon les propos de Jill Seaman, le médecin qui a conduit une mission humanitaire sur le Nil supérieur pour l'organisation française Médecins sans Frontières, « dans quelle autre région du monde 50% de la population pourrait-elle mourir sans que personne n’en sût rien ? » [15]
L’incapacité du monde à signaler l'épidémie n'était pas seulement due à des structures archaïques, mais également à des considérations politiques. Quand, en 1991, un groupe de chercheurs soudanais avec l'organisation mondiale de la santé a averti de la survenue d'une prochaine épidémie de kala-azar et proposé la construction d'un centre de traitement, le gouvernement soudanais est intervenu et a nié l'existence d’une quelconque épidémie. En guerre avec son propre peuple, le gouvernement de Khartoum ne souhaitait pas voir des étrangers aider la population et a préféré utiliser le contrôle de l'aide étrangère comme un moyen d’intervention politique. L'OMS, une organisation non gouvernementale, ne pouvait rien faire face à l'opposition du gouvernement d’un pays hôte, et ainsi rien n'a été fait. Pendant une grande partie des années 1990, Médecins sans Frontières a lutté contre la maladie pratiquement seule, travaillant non seulement sans frontières mais également sans hôpitaux et sans visas. [14]
L'OMS estime qu'il y aurait 500 000 nouveux cas[16] et 50 000 morts[17] dans le monde chaque année.
Notes et références
- ↑ a et b A Small Charity Takes the Reins in Fighting a Neglected Disease, New York Times, July 31, 2006.
- ↑ [1]http://www.who.int/mediacentre/factsheets/fs116/en/
- ↑ Chappuis F, Rijal S, Soto A, Menten J, Boelaert M., « A meta-analysis of the diagnostic performance of the direct agglutination test and rK39 dipstick for visceral leishmaniasis », dans Brit Med J, vol. 333, no 7571, p. 723–6 [lien DOI]
- ↑ Sundar S, Singh RK, Maurya R, et al., « Serological diagnosis of Indian visceral leishmaniasis: dirrect agglutination test versus rK39 strip test », dans Trans R Soc Trop Med Hyg, vol. 100, p. 533–7
- ↑ Sundar S, Maurya R, Singh RK, et al., « Rapid, noninvastive diagnosis of visceral leishmaniasis in India: comparison of two immunochromatographic strip tests for detection of anti-K39 antibody », dans J Clin Microbiol, vol. 44, 2006, p. 251–3
- ↑ a et b Lockwood DNJ, Sundar S., « Serological tests for visceral leishmaniasis », dans Brit Med J, vol. 333, 2006, p. 711–12
- ↑ Pasquau F, Ena J, Sanchez R, et al., « Leishmaniasis as an opportunistic infection in HIV-infected patients: determinants of relapse and mortality in a collaborative study of 228 episodes in a Mediterranean region », dans Eur J Clin Microbiol Infect Dis, vol. 24, 2005, p. 411–18
- ↑ Sundar S et al., « Failure of pentavalent antimony in visceral leishmaniasis in India: report from the center of the Indian epidemic », dans Clin Infect Dis, vol. 31, 2000, p. 1104–7
- ↑ Thakur CP et al., « Epidemiological, clinical & pharmacological study of antimony-resistant visceral leishmaniasis in Bihar, India », dans Clin Infect Dis, vol. 120, 2004, p. 166–72
- ↑ Thakur CP, Singh RK, Hassan SM, Kumar R, Narain S, Kumar A, « Amphotericin B deoxycholate treatment of visceral leishmaniasis with never modes of administration and precautions: a study of 938 cases », dans Trans R Soc Trop Med Hyg, vol. 93, p. 319–23
- ↑ Thakur CP, Pandey AK, Sinha GP, Roy S, Behbehani K, Olliaro P, « Comparison of three treatment regimens with liposomal amphotericin B (AmBisome) for visceral leishmaniasis in India: a randomized dose-finding study », dans Trans R Soc Trop Med Hyg, vol. 90, 1996, p. 319–22
- ↑ Sundar S. et al., « Amphotericin B colloidal dispersion for the treatment of Indian visceral leishmaniasis », dans Clinical Infectious Diseases, vol. 42, no 5, 2006, p. 608–13
- ↑ Sundar S, Jha TK, Thakur CP et Als, Injectable Paromomycin for visceral leishmaniasis in India, New Eng J Med, 2007:356:2571-2581
- ↑ a , b et c Jean, Francois, « Sudan: Speak no Evil, Do no Good », dans Life, Death and Aid: The Medicins Sans Frontieres Report on World Crisis Intervention, 1995
- ↑ Dowell, William, « Rescue in Sudan », dans Time, 1997
- ↑ Urbanisation: facteur de risque croissant pour la leishmaniose
- ↑ Visceral leishmaniasis: what are the needs for diagnosis, treatment and control?
- Portail de la médecine
Catégories : Maladie infectieuse tropicale | Infection parasitaire
Wikimedia Foundation. 2010.