- Trifluorure d'azote
-
Trifluorure d'azote 
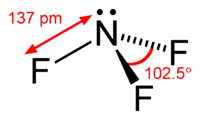
Général Nom IUPAC Trifluorure d'azote Synonymes trifluoramine No CAS No EINECS SMILES InChI Apparence gaz incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute NF3 Masse molaire[3] 71,0019 ± 0,0002 g·mol-1
F 80,27 %, N 19,73 %,Moment dipolaire 0,235 ± 0,004 D [2] Propriétés physiques T° fusion -208,5 °C[1] T° ébullition -129,1 °C (144,05 K)
(à 1 013 hPa)Solubilité dans l'eau : nulle[1] Masse volumique 3,003 kg·m-3 (gaz à 24,85 °C
et 1 013 hPa)
1 540 kg·m-3 (liquide à 1 013 hPa au point de vaporisation)Thermochimie ΔvapH° 11,56 kJ·mol-1 (1 atm, -128,75 °C)[4] Propriétés électroniques 1re énergie d'ionisation 13,00 ± 0,02 eV (gaz)[5] Précautions Directive 67/548/EEC 
Xn
OPhrases R : 8, 20, [6] Phrases S : 9, 17, 23, [6] Transport 25 2451 [6]SIMDUT[7] 

Unités du SI & CNTP, sauf indication contraire. Le trifluorure d'azote est un composé inorganique de formule brute NF3. Ce composé azote-fluor est un gaz incolore, toxique, inodore, non inflammable. Il est de plus en plus utilisé comme graveur chimique en micro-électronique.
Sommaire
Applications
Le trifluorure d'azote est utilisé pour la gravure ionique réactive des wafers en silicium. Le NF3 y est décomposé in situ en azote et fluor, et les radicaux fluor obtenus agissent comme des agents nettoyants qui attaquent le silicium. Il peut être aussi utilisé avec le nitrure de silicium, le siliciure de tungstène, et le tungstène produits par dépôt chimique en phase vapeur. Dans toutes ces applications, le NF3 a été choisi vers l'an 2000 comme substitut plus protecteur pour l'environnement aux perfluorocarbures comme l'hexafluoroéthane (C2F6) et l'hexafluorure de soufre (SF6)[8]. Les deux tiers environ des PFC s'échappaient dans l'atmosphère ; on considérait que le NF3 avait de bien moindres chances de s'échapper dans l'air.
Le trifluorure d'azote est aussi utilisé dans les lasers à fluorure d'hydrogène et de deutérium, qui sont deux types de lasers à gaz. On le préfère au difluor gazeux parce qu'il est plus facile à manipuler, car considérablement plus stable.
On peut l'utiliser avec l'acier et le Monel, ainsi qu'avec plusieurs plastiques.
Synthèse et réactivité
Le NF3 est un exemple rare de fluorure binaire qu'on ne peut pas préparer directement à partir de ses éléments (c'est-à-dire que N2 ne réagit pas avec F2). Presque tous les autres éléments du tableau périodique réagissent directement, souvent de manière violente, avec le fluor.
Après une première tentative en 1903, Otto Ruff a réussi, 25 ans plus tard, à synthétiser le trifluorure d'azote par l'électrolyse d'un mélange fondu de fluorure d'ammonium et de fluorure d'hydrogène[9]. Il s'est avéré beaucoup moins réactif que le trichlorure d'azote. Il est aujourd'hui préparé par une réaction directe d'ammoniac et de fluor, et une variante de la méthode de Ruff[10].
On peut s'en procurer sous la forme de cylindres pressurisés.
Réactions
Le NF3 est légèrement soluble dans l'eau sans qu'aucune réaction chimique n'ait lieu. Son moment dipolaire est faible (0,2340 D)[11]. NF3 est un oxydant puissant bien que lent. Au contact de métaux, il se transforme en tétrafluorohydrazine, mais seulement à haute température :
- 2 NF3 + Cu → N2F4 + CuF2
NF3 réagit avec le fluor et le pentafluorure d'antimoine pour donner le sel de tétrafluoroammonium:
- NF3 + F2 + SbF5 → NF4+SbF6-
Gaz à effet de serre
Le NF3 ne fait pas partie des gaz à effet de serre réglementés par le Protocole de Kyoto.
Bien que le NF3 ait un potentiel de réchauffement global élevé (estimé 17 200 fois celui du CO2 sur une période d'un siècle, ce qui le place en second sur ce critère, derrière le SF6 [12] ,[13],[14].), son forçage radiatif dans l'atmosphère terrestre est très faible, estimé à 0,001 W.m-2, puisqu'il n'y est relâché que dans des quantités très faibles : en 2008, le contenu total de ce gaz dans l'atmosphère est estimé à 5 400 tonnes (en augmentation d'environ 11 pour cent par an), et sa concentration maximum dans l'atmosphère telle qu'elle est évaluée est inférieure à 0,16 parties par billion (ppt) en volume[15]. Une étude de 2008, utilisant des techniques d'échantillonnage améliorées a trouvé une concentration troposphérique planétaire moyenne de 0,454 parties par billion (ppt) par fraction de mole d'air sec[16]. Sa durée de séjour dans l'atmosphère est estimée à 740 ans[12], bien que des travaux récents suggèrent une durée légèrement plus courte de 550 ans (et un PRG correspondant de 16 800 fois celui du CO2)[17].
Les applications industrielles utilisant le NF3 le décomposent, alors que les composés réglementés que sont le SF6 et les PFC sont généralement relâchés dans l'air[17],[18].
Volume de production
Depuis 1992, où moins de 100 tonnes étaient produites, la production mondiale a grimpé pour atteindre de l'ordre de 4 000 tonnes en 2007. On estime qu'elle continuera à augmenter de manière significative dans les années qui viennent[17], pour atteindre environ 8 000 tonnes par an en 2010.
Sécurité
Le contact avec la peau du NF3 n'est pas dangereux, et ce gaz est un irritant relativement faible pour les muqueuses et les yeux. C'est aussi un irritant pulmonaire : sa toxicité est comparable à celle des oxydes d'azote, et une surexposition par inhalation transforme l'hémoglobine du sang en méthémoglobine, ce qui provoque un état de méthémoglobinémie[19].
Voir aussi
Références
- TRIFLUORURE D'AZOTE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Entrée du numéro CAS « 7783-54-2 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 novembre 2008 (JavaScript nécessaire)
- « Trifluorure d’azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) H. Reichardt, A. Frenzel et K. Schober, « Environmentally friendly wafer production: NF3 remote microwave plasma for chamber cleaning », dans Microelectronic Engineering, vol. 56, no 1-2, 2001, p. 73-76 [lien DOI].
- (de) Otto Ruff, Joseph Fischer et Fritz Luft, « Das Stickstoff-3-fluorid », dans Zeitschrift für anorganische und allgemeine Chemie, vol. 172, no 1, 1928, p. 417–425 [lien DOI].
- Philip B. Henderson, Andrew J. Woytek "Fluorine Compounds, Inorganic, Nitrogen" in Kirk‑Othmer Encyclopedia of Chemical Technology, 1994, John Wiley & Sons, NY. DOI:10.1002/0471238961.1409201808051404.a01 Article Online Posting Date: December 4, 2000
- Thomas M. Klapötke “Nitrogen–fluorine compounds” J. Fluor. Chem. Volume 127, 2006, pp. 679-687. DOI:10.1016/j.jfluchem.2006.03.001
- Erreur dans la syntaxe du modèle Article(en) « Climate Change 2007: The Physical Sciences Basis », dans , IPCC [texte intégral [PDF] (page consultée le 3 juillet 2008)].
- (en) J.I. Robson, L.K. Gohar, M.D. Hurley, K.P. Shine et T. Wallington, « Revised IR spectrum, radiative efficiency and global warming potential of nitrogen trifluoride », dans Geophys. Res. Lett., vol. 33, 2006 [texte intégral, lien DOI]
- Richard Morgan : Beyond Carbon: Scientists Worry About Nitrogen’s Effects (2008-09-01). mirror
- (en) Jon Robson, « Nitrogen trifluoride (NF3) », dans Royal Meteorological Society, 27 octobre 2008 [texte intégral].
- (en) Ray F. Weiss, J. Mühle, P.K. Salameh et C.M. Harth, « Nitrogen trifluoride in the global atmosphere », dans Geophys. Res. Lett., vol. 35, no L20821, 31 octobre 2008 [texte intégral, lien DOI].
- (en) M.J. Prather et J. Hsu, « NF3, the greenhouse gas missing from Kyoto », dans Geophys. Res. Lett., vol. 35, 2008 [texte intégral, lien DOI].
- (en) W.-T. Tsai, « Environmental and health risk analysis of nitrogen trifluoride (NF3), a toxic and potent greenhouse gas », dans J. Hazard. Mat., 2008 [lien DOI].
- Yogender Malik, « Nitrogen trifluoride - Cleaning up in electronic applications », 2008-07-03
Catégories :- Produit chimique nocif
- Produit chimique comburant
- Composé de l'azote
- Fluorure
- Gaz à effet de serre
Wikimedia Foundation. 2010.


