- Electrolyse a haute temperature
-
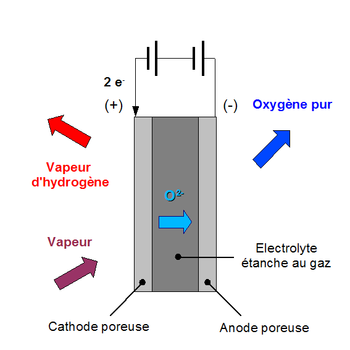
Électrolyse à haute température
L'électrolyse à haute température (ou HTE d'après l'acronyme anglais de High-temperature electrolysis ou électrolyse en phase vapeur) est une méthode actuellement étudiée pour la production d'hydrogène à partir de l'eau avec l'oxygène comme produit secondaire.
Sommaire
Présentation générale
Généralités
L'électrolyse sous haute température pourrait dans le futur s'avérer plus efficace que l'électrolyse de l'eau à température ambiante, parce qu'une partie de l'énergie nécessaire à la réaction peut être apportée par la chaleur (moins chère que l'électricité) et que l'activation de la réaction (meilleur rendement) est plus efficace à haute température. En fait, à 2 500 °C (soit 2773 K), plus aucun apport de travail ne serait plus nécessaire en raison d'une réaction de thermolyse qui décompose l'eau en hydrogène et oxygène (sous réserve qu'on arrive à séparer l'hydrogène et l'oxygène produit). Cependant, de telles températures ne sont pas pratiques : les systèmes HTE fonctionnent généralement entre 100 °C et 850 °C.
Applications
Comparaisons avec d'autres procédés
L'électrolyse à haute température est difficilement comparable avec la conversion chimique des hydrocarbones ou de l'énergie du charbon en hydrogène, puisqu'aucune de ces conversions n'est limitée par le rendement d'une machine thermique et que leur transformation émet du CO2. Ainsi, les sources possibles d'énergie thermique pour la HTE sont toutes non-chimiques, incluant les réacteurs nucléaires, les collecteurs d'énergie solaire et les sources géothermiques.
Si l'on dispose d'une source de chaleur à haute température peu chère, d'autres méthodes de production sont possibles. En particulier, on pourra se référer au cycle thermodynamique soufre-iode. Une production thermochimique pourrait atteindre des rendements plus intéressants que la HTE, aucune machine électrique n'étant théoriquement requise (la pratique montre que ce n'est cependant pas le cas, sur les cycles actuellement répertoriés). D'un autre coté, on pourrait argumenter qu'une production thermochimique à grande échelle nécessitera des avancées significatives dans des matériaux pouvant supporter des hautes pressions, des hautes températures, des milieux hautement corrosifs. Mais on retrouve hélas ces difficultés pour l'électrolyse haute température (les phénomènes sont moins prononcés mais plus difficilement contrôlables car on ne bénéficie pas de l'effet de volume des cycles thermo-chimiques).
La base de comparaison reste de fait l'électrolyse alcaline. En pratique les rendements potentiels du puits (l'eau) à la roue (hydrogène) sont quasi équivalents (et même légèrement à l'avantage de l'électrolyse alcaline, pour laquelle le coût de la séparation oxygène/eau est plus faible) (voir le paragraphe plus bas sur le procédé). Tout se joue donc sur les pertes de procédés à l'échelle industrielle et sur le couple coût/durée de vie des électrolyseurs, ce dernier étant actuellement très à l'avantage de l'électrolyse alcaline. Ceci explique que les recherches sur l'électrolyse haute température, initiées dans les années 70 n'aient pas encore débouché sur un pilote pré-industriel.
Économie de l'hydrogène (remarque)
Le marché de l'hydrogène est important (50 millions de tonnes par an en 2004, soit environ 135 milliards de dollars par an) et grandit d'environ 10 % par an (voir économie de l'hydrogène). Les deux consommateurs majeurs sont actuellement les raffineries pétrolières et les usines d'engrais (chacun consommant près de la moitié de la production totale). Lorsque les automobiles à propulsion basée sur l'hydrogène se répandront, leur consommation augmentera énormément la demande d'hydrogène.
Sur le procédé
Durant l'électrolyse, la quantité d'énergie électrique à apporter doit être au moins égale à la variation de l'énergie libre de Gibbs de la réaction additionnée des pertes du système. Les pertes peuvent (théoriquement) être arbitrairement proche de zéro, et ainsi le rendement thermodynamique du procédé proche de 100 %.
Dans la majorité des cas, comme dans l'électrolyse de l'eau à température ambiante, l'apport électrique est plus important que la variation d'enthalpie de la réaction, et donc de l'énergie est gaspillée en chaleur perdue. Dans d'autres cas cependant, comme l'électrolyse de la vapeur en hydrogène et oxygène à haute température, on peut espérer théoriquement faire l'inverse. La chaleur serait absorbée depuis l'environnement, et la quantité de chaleur équivalente à l'hydrogène produit est plus importante que l'énergie électrique fournie. Dans ce cas, on pourrait croire que le rendement énergétique est supérieur à 100 %. Cependant il faut considérer le procédé dans sa globalité ( de l'eau à 25 °C, 1 bar à l'hydrogène à 25 °C, 1 bar), ce qui amène des dépenses énergétiques complémentaires : - d'une part la source de chaleur à haute température doit être comptabilisée au bilan énergétique - ensuite la montée en température a un coût énergétique : en effet il coûte plus cher de chauffer les réactifs (ici l'eau) que l'énergie récupérable par le refroidissement des fluides sortants (oxygène et hydrogène) - enfin cette réaction est incomplête (d'après la loi de Nernst) sauf à fonctionner avec de fortes surtensions à l'électrolyse. cela oblige à faire recirculer beaucoup plus d'eau que d'hydrogène produit, ce qui engendre un cout supplémentaire lié à la vaporisation de cette eau introduite (on ne peut pas, conformément à la seconde loi de la thermodynamique, récupérer directement l'énergie de condensation de l'eau qui n'a pas réagi pour vaporiser l'eau en entrée). - enfin il faut comptabiliser au bilan la surtension nécessaire pour faire passer l'oxygène à travers la membrane, sachant qu'il faut impérativement éviter que celui-ci reste avec l'hydrogène créé).
On s'aperçoit alors qu'en pratique, le rendement potentiel d'un procédé d'électrolyse haute température, du puits (l'eau à 25 °C) à la roue (l'hydrogène produit) n'est guère meilleur que le rendement industriel d'une simple électrolyse alcaline.
Un autre problème de ce type de procédé est le coût très élevé des matériaux utilisés et leur durée de vie, actuellement de plusieurs ordres de grandeur inférieure à celle d'électrolyseurs alcalins. Les phénomènes de corrosion sont en effet exacerbés à haute température et les contraintes thermo-mécaniques beaucoup plus importantes pour ce type de procédé.
Voir aussi
Référence
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « High-temperature electrolysis ».
- Portail de la chimie
Catégories : Électrolyse | Production d'hydrogène
Wikimedia Foundation. 2010.