- Dilutions
-
Dilution
 Pour les articles homonymes, voir Dilution (homonymie).
Pour les articles homonymes, voir Dilution (homonymie).La dilution est un procédé consistant à obtenir une solution finale de concentration inférieure que celle de départ, soit par ajout de solvant, soit par prélèvement d'une partie de la solution et en complétant avec du solvant pour garder le même volume. La dilution se caractérise par son taux de dilution. Cette notion présuppose que le corps dilué soit soluble dans le solvant utilisé.
Sommaire
La concentration
La concentration molaire d'une solution est notée :
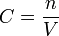 avec n la quantité de soluté en solution dans le volume V de solvant.
avec n la quantité de soluté en solution dans le volume V de solvant.Selon que n est exprimée en unité de masse, ou de quantité de matière, C est une concentration massique ou molaire.
- La solution initiale et la solution finale contiennent autant de quantité de soluté : ninitale = nfinal ;
- La solution initiale a pour volume Vinitial, la solution finale Vfinal ;
- La concentration initiale, étant Cinitiale, la concentration finale, Cfinale ;
- Le rapport entre les deux solutions est le suivant :
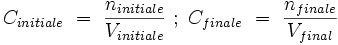
or, ninitiale = nfinale
-
-
- Donc :
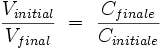
- Donc :
-
Taux de dilution
Le taux de dilution peut être exprimé par :
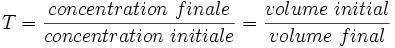
T est un nombre compris entre 0 et 1, sans unité.
Le taux de dilutions successives est le produit des taux de dilution de chaque dilution. Par exemple, si on fait une dilution à 3% puis à 5 % on a :
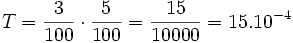 ,
,Taux de dilution en homéopathie
Il existe des dilutions en homéopathie à partir de matériaux non solubles et de matériaux solubles.
Dilutions solides
Pour les matériaux non solubles les homéopathes procèdent dans un mortier à une déconcentration solide dans du sucre: Les substances chimiques ou minérales insolubles sont déconcentrées par trituration dans du lactose jusqu'à l'obtention du seuil de solubilité requis. Ceci permettra de préparer la première dilution liquide.
Dilutions liquides
 dilutions successives au centième (1 CH, 2 CH et 3 CH) d'éosine. Les solutions obtenues sont de 1%, 10-4 et 10-6
dilutions successives au centième (1 CH, 2 CH et 3 CH) d'éosine. Les solutions obtenues sont de 1%, 10-4 et 10-6
Les préparations homéopathiques sont fabriquées à partir d'une teinture mère qui est diluée successivement : la méthode la plus courante en homéopathie étant de diluer par 100. Au bout d'un certain nombre de dilutions, on obtient un taux de dilution très petit. Une notation spécifique à l'homéopathie, donnant le nombre de dilutions successives, est utilisée :
- DH, pour dixième hanhemanniène (du nom de l'inventeur de l'homéopathie), correspond à une dilution par 10 ;
- CH ou centésimal hanhemanniène est la plus utilisée et correspond à une dilution par 100.
Remarque : si la concentration de la teinture mère est connue (X), la concentration du produit (xd) dilué à n CH est donnée par la formule suivante :
-
-
- xd = X . 10-2n tant que les dilutions n'atteignent un taux de dilution nul.
-
Cette formule montre que deux préparations à 5CH peuvent avoir des concentrations fort différentes : il suffit que l'on ait utilisé des teintures mères ayant des concentrations de départ (X1) et (X2) très différentes.
Exemples :
- Supposons que la teinture mère contient N=10+24 molécules actives, soit x grammes, les dilutions successives en contiennent 100 fois moins à chaque dilution et, à 12CH, il ne reste plus, statistiquement, qu'une "particule" active : environs x 10-24grammes, la masse d'une molécule.
CH 1 2 3 4 5 6 7 8 9 10 11 12 13 > 13 N 10+22 10+20 10+18 10+16 10+14 10+12 10+10 10+8 10+6 10+4 100 1 0 0 À 13CH, le taux de dilution sera de 12 CH si, dans le 1% prélevé, on a eu la chance (1/100) de prélever la particule, et de 0% sinon (avec un taux de dilution nul), et de même aux dilutions suivantes. Toute dilution, au-delà de 12 CH, est donc inutile.
- Si, dans 10 24 molécules d'eau pure ( soit 1,66 moles ou 29,89 g), on dépose une "particule" (réalisable par la cytométrie en flux), on a un taux de dilution de 10 -24 équivalent à 12 CH. Contrairement à l'homéopathie, on voit qu'il est possible de mettre une "particule" active :
- 13CH : une "particule" active dans 3 litres d'eau ;
- 14CH : dans 300 litres d'eau ;
- 15CH : dans 30 m³ d'eau, etc.
La limitation à 12CH signalée par le tableau est uniquement due à la méthode de prélèvement centésimal utilisée en homéopathie. En effet, en sciences, rien n'empêche d’atteindre toute dilution que l'on veut prédéfinie, à condition qu'elle soit rationnelle au sens mathématique du terme.
- Une autre approche des dilutions en homéopathie
Le formalisme ci-dessus peut être compris grâce à une autre approche : la dernière dilution est constituée de 99% d'eau provenant de l'eau utilisée pour diluer, et de 1% de la dilution antérieure, elle même à 99% constituée d'eau. De ce fait, si on considère les 5 dernières dilutions, la solution obtenue est constituée de : 99%+0,99%+0.0099%+0,000099%+0,00000099% = 99,99999999% d'eau de dilution n'ayant pas été en contact avec le principe actif, et de 0,00000001% issu des dilutions antérieures ayant été en contact avec le "principe actif".
En synthèse
Il faut retenir que :
- 0 CH est la préparation initiale constituée de quelques % à 100% de molécules actives ;
- et que au delà de 12 CH, il y a 0% de molécules actives dans les granules de sucre ;
- avec le fait que à 3CH, il n'y a que au plus 0,0001% de molécules actives dans un gramme de sucre.
Dilution de Korsakov
K signifie que le russe Semen Korsakov est l'auteur d'un système de dilution différent de celui de Hanemann. Au lieu de changer de flacon à chaque dynamisation, ce procédé vide simplement le flacon après chaque dynamisation, en considérant qu'il reste un centième du volume initial. Cette méthode a permis d'automatiser le procédé, et a conduit à l'obtention de dynamisations très poussées ; jusqu'à un million de fois (MM Korsakov). En pratique, il est constaté expérimentalement que le nombre de secousses auxquelles a été soumise la préparation (100 millions de coups pour la MMK), influe sur la dilution qui est modifiée ; elle est parfois beaucoup plus faible que celle attendue et non mesurable. La SPR montre que l'interaction d'une molécule avec une paroi peut être mesurée, et les ultrasons permettent de nettoyer les surfaces des molécules qui y ont adhéré. Il n'est donc pas étonnant que les secousses influent sur la dilution obtenue par la méthode de Korsakov .
Voir aussi
- Portail de la chimie
Catégories : Chimie générale | Chimie analytique
Wikimedia Foundation. 2010.

