- Chromatograpie échangeuse d'ions
-
Chromatographie à échange d'ions
 Chromatographe ionique de Metrohm
Chromatographe ionique de Metrohm
La chromatographie à échange d’ions (ou chromatographie à ions ou chromatographie échangeuse d'ions) est un type de chromatographie en phase liquide permettant d'isoler une substance chargée électriquement d'un mélange de molécules chargés (liquide). Pour cela, on fait passer le mélange sur une phase stationnaire (solide) chargée déjà associée à des ions connus et on remplace ces ions par les ions/molécules chargées du mélange à séparer. C’est une technique chromatographique couramment utilisée en chimie analytique, notamment pour le contrôle de la qualité de l’eau.
Sommaire
Principe
- R-X la phase stationnaire.
- A un anion connu.
- C un cation connu.
- M et B les constituants du mélange.
1. Phase stationnaire échangeuse de cations : M se fixe, C est élué avec B
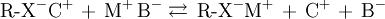
2. Phase stationnaire échangeuse d'anions : B se fixe, A est élué avec M
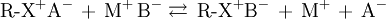
Phase stationnaire
Les phases stationnaires utilisées en chromatographie à ions sont des résines échangeuses d’ions synthétiques, soit des « matériaux polymériques de masse molaire élevée qui contiennent de nombreux groupements fonctionnels ioniques par molécule. »[1] En chromatographie à ions, une phase stationnaire peut contenir soit des groupements fonctionnels anioniques (pour les échanges de cations), soit cationiques (pour les échanges d’anions). Avec une phase stationnaire comprenant des cations, les anions progresseront dans la colonne à des vitesses différentes selon leur charge, leur taille et leur polarisabilité[2] et les cations ne seront pas retenus lors de leur parcours dans la colonne (vu qu’ils ne feront pratiquement pas d’interactions avec la phase stationnaire).
Éluant
La force de l’éluant en chromatographie à ions est déterminée par jusqu’à quel point il est ionique. Plus un éluant contient des ions, plus l’ion d’intérêt va éluer rapidement. Par exemple, si l’ion d’intérêt est un anion, augmenter la force de l’éluant aura comme effet qu’il y aura davantage d’anions provenant de l’éluant pour faire compétition à l’anion d’intérêt pour le nombre limité de sites cationiques de la phase stationnaire. L’anion d’intérêt pourra donc faire moins d’interactions avec la phase stationnaire et sera donc moins retenu par la colonne d’où l’élution plus rapide.
Détection
Un détecteur de conductivité est souvent utilisé avec ce type de chromatographie vu la nature ionique des analytes. Une colonne de neutralisation de l’éluant est habituellement combinée à ce type de détecteur afin de supprimer la conductivité de l’éluant sans toutefois affecter celle de l’analyte.[1] Ceci présente l’avantage de permettre l’utilisation de plus faibles concentrations en analyte pour obtenir une sensibilité acceptable.
Littérature
- Chromatographie ionique pratique - une introduction de C. Eith, M. Kolb, A. Seubert, K. Viehweger, Metrohm AG, Réf. 8.792.5002 (gratuit)
- Chromatograpie ionique de H. Schäfer, M. Läubli, R. Dörig, Metrohm AG, Réf. 8.732.2002 (gratuit)
Liens internes
Notes et références
- ↑ a et b Skoog, D.A., West, D.M. et F.J. Holler, Chimie analytique, 1ère édition, Bruxelles, Édition De Boeck, 1997, p. 710-714.
- ↑ Hedrick, E. et T. Behymer, U.S. EPA Determination of Perchlorate in Drinking Water by Ion Chromatography with Suppressor Conductivity and Electrospray Ionization Mass Spectroscopy [En ligne]. Mars 2005 [21 mars 2008]. Disponible sur Web : http://www.epa.gov/nerlcwww/m_332_0.pdf
- Portail de la biochimie
- Portail de la chimie
Catégorie : Chromatographie
Wikimedia Foundation. 2010.
