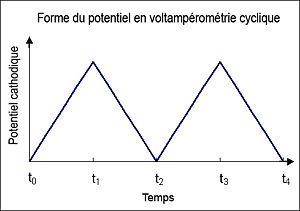
- Voltamétrie cyclique
-
Voltampérométrie cyclique
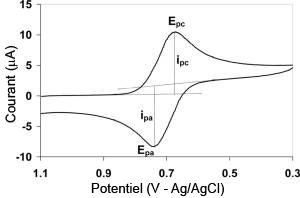 Exemple de diagramme voltampérométrie cyclique
Exemple de diagramme voltampérométrie cyclique
La voltampérométrie cyclique (ou voltammétrie cyclique) est un type particulier de mesure électrochimique potentiodynamique. Pour obtenir un diagramme voltampérométrie cyclique, le potentiel appliqué doit varier dans la solution, et la variation de courant électrique est mesurée par rapport à celle du potentiel. Ce type de voltammétrie est utilisé pour étudier les propriétés redox des structures d'interface, et de composés chimiques à l'interface de l'électrode.
Sommaire
Description
Dans une expérience de voltammétrie, comme dans d'autres expériences à potentiels contrôlés, un potentiel est appliqué au système, et le courant faradique de réponse est mesuré (un courant faradique est un courant dû à la réaction d'oxydo-réduction). La réponse au courant sur un intervalle de potentiels (une fenêtre de potentiels) est mesurée, partant d'une valeur initiale et avec une variation linéaire du potentiel jusqu'à une valeur limite pré-définie. À ce potentiel (parfois indiqué comme potentiel d'inversion), le sens du balayage de potentiel est inversé, et la même fenêtre de potentiel est balayée dans le sens opposée (d'où le terme cyclique). Ceci signifie que, par exemple, les espèces formées par oxydation lors du premier balayage (direct) peuvent être réduites lors du second balayage (inverse).
Cette technique est couramment utilisée, en raison de sa simplicité et de sa rapidité pour la caractérisation initiale d'un système redox actif. En plus de fournir une estimation du potentiel redox, cette technique peut aussi donner de l'information sur le taux de transfert électronique entre l'électrode et l'analyte, et sur la stabilité de l'analyte dans les états d'oxydation électrolysés (soit s’ils dépendent d'une quelconque réaction chimique).
Pour la majorité des expériences, les espèces électroactives se trouvent sous la forme d'une solution. La méthode des trois électrodes est la technique la plus répandue puisque le potentiel électrique de référence ne change pas facilement durant la mesure.
La méthode utilise une électrode de référence, une électrode de travail, et une contre-électrode (aussi appelée électrode secondaire ou électrode auxiliaire). Un électrolyte support est habituellement ajoutée à la solution afin d'assurer une conductivité suffisante. La combinaison du solvant, de l'électrolyte et du matériel d'électrode spécifique utilisé détermine le domaine d'électroactivité (domaine de potentiel à l'intérieur duquel le solvant - ou l'électrolyte support - ne subissent pas de réactions d'oxydoréduction ; soit le domaine de potentiel à l'intérieur duquel l'analyse peut être réalisée).Principe de voltampérométrie cyclique
En voltampérométrie cyclique, le potentiel d'électrode suit un potentiel modifié linéairement avec le temps, comme montré ci-contre.
Le potentiel est mesuré entre l'électrode de référence et l'électrode de travail et le courant est mesuré entre l'électrode de travail et la contre-électrode. Ces données sont ensuite tracées comme l'intensité (i) fonction du potentiel (E). Comme le montre la forme du potentiel, le balayage qui s'ensuit produit un pic de courant pour tous les analytes qui peuvent être réduits dans l'intervalle de potentiel du balayage. Le courant s'accroît lorsque le potentiel atteint le potentiel de réduction de l'analyte, puis chute lorsque la concentration de l'analyte est en baisse autour de la surface de l'électrode. Lorsque le potentiel appliqué est inversé, il atteindra le potentiel qui réoxydera le produit formé lors de la première réaction de réduction, et produit un courant de polarité inversée lors du balayage suivant. Le pic d'oxydation aura de manière usuelle une forme similaire au pic de réduction. Par conséquent, l'information sur le potentiel redox et les proportions de composés obtenus lors de la réaction électrochimique.
Ainsi, par exemple, si le transfert électronique à la surface est rapide et que le courant est limité par la diffusion des espèces vers l'électrode de surface, le pic de courant sera proportionnel à la racine carrée de la vitesse de balayage.
Électrodes
Les électrodes peuvent être statiques ou tournantes. Avec la rotation, la convection est assurée, mais la diffusion comme procédé unique (c'est-à-dire comme processus limitatif) est éliminé. Des électrodes de voltampérométrie courantes peuvent être du carbone vitreux, du platine, et/ou de l'or.
Dans certaines expériences, les espèces électroactives sont fixées sur la surface comme par exemple pour la voltammétrie de microparticules. Ainsi, le terme de voltampérométrie cyclique est utilisé pour décrire les expériences dans lesquels deux liquides non miscibles (chacun d'entre eux contenant une électrode de référence et une contre-électrode) sont en contact. De telles cellules à quatre électrodes utilisent l'interface entre les deux liquides comme électrodes de travail.Techniques potentiodynamiques
Il existe aussi des techniques potentiodynamiques qui ajoutent une perturbation de courant alternatif (AC) de faible amplitude à une rampe de potentiel et mesurent la réponse variable dans une seule fréquence (voltampérométrie AC) ou dans plusieurs fréquences simultanément (spectroscopie d'impédance électrochimique potentiodynamique). La réponse à un courant alternatif est bidimensionnelle - elle est caractérisée par une amplitude et une phase. L'amplitude et la phase dépendent différemment de la fréquence des constituants de la réponse AC attribués aux différents procédés (transferts de charge, diffusion, charge de double charge, etc.). L'analyse de la réponse en fréquence permet une surveillance simultanée des nombreux procédés qui peuvent contribuer à la réponse potentiodynamique AC du système électrochimique.
Voir aussi
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Cyclic voltammetry ».
- Portail de la chimie
Catégorie : Électrochimie
Wikimedia Foundation. 2010.