- Sam68
-
Sam68 est une protéine de 443 acides aminés codée par un gène situé sur le chromosome 1p32.
Autres noms :Domaine contenant une KH, RNA-binding, signal de transduction associé 1, GAP-associé à une tyrosine phosphoprotéine p. 62
Fonctionnement dans la cellule
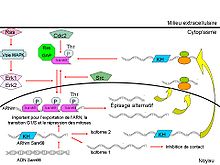
Alors que la régulation transcriptionnelle est souvent vue comme la voie la plus répandue des signaux extracellulaires pour réguler l'expression des gènes, la régulation post-transcriptionnelle de l'épissage, la stabilité de l’ARN et la traduction sont eux aussi réglées par des signaux extracellulaires. Sam68, un membre de la famille "ARN-binding" protéines ou protéines STAR, peut prendre deux voies d’épissage en réponse aux différents signaux extracellulaires. "L’ARN-binding" et l'activité de SAM68 sont réglés par des signaux provenant de la phosphorylation et par la modulation de leurs interactions avec d'autres protéines ainsi qu’avec l'ARN. Sam68 est localisé dans le noyau dans une infrastructure spécifique appelée corps nucléaire Sam68/SLM, qui abrite aussi les facteurs nécessaires à l’épissage. Cette protéine pourrait faire le lien entre la transduction de signal et le traitement de l’ARN. Sam68 pourrait aussi jouer un rôle dans une variété de réactions, tel la signalisation du taux d’insuline et l'expression du gène du VIH. De plus, il peut-être réglé par la méthylation de l’arginine aussi bien que par phosphorylation. En plus de son rôle dans l’expression post-transcriptionnelle de gène, Sam68 agit aussi réciproquement avec des facteurs de transcription comme CBP et semble régler l'expression de certains gènes.
Sam68 semble aussi jouer un rôle dans la progression de cycle cellulaire par l'influence du traitement de l’ARN. Elle contient plusieurs régions riches en proline et une partie C-terminale riche en tyrosine. Pendant sa mitose, SAM68 voit une de ces tyrosines être phosphorylée, ceci lui permet d'interagir notamment avec les domaines SH3 (SH = Src Homology) et SH2 des tyrosines kinases de la famille Src. L'interaction de Sam68 avec l'ARN est réprimée par cette phosphorylation, tandis que l'interaction de Sam68 avec le Ras-GAP est stimulée par cette phosphorylation. Sam68 semble être un gène suppresseur de tumeurs et des cellules transformées car son expression est réduite pendant la mitose, ce qui pourrait mener à l’inhibition de la prolifération des cellules. Sam68 possède deux domaines fonctionnels : KH et RGG. Ces derniers permettent son association avec l'ARN. L’absence du domaine KH dans une isoforme épissée exprimé par des cellules montre l'inhibition de contact de croissance cellulaire. De plus, Sam68 avec son domaine KH semblent quelques fois stimuler la transition G1/S, en bloquant la mitose.
Sam68 et le VIH
RRE agit dans la régulation de VIH-1 pour retenir l’ARN non épissée ou partiellement épissée dans le noyau. La protéine Rev du VIH-1 se lie au RRE et facilite l'exportation de l’ARNm contenant le RRE du nucléus au cytoplasme. Le commencement de la dernière phase de réplication du VIH-1 se produit quand le niveau de protéine Rev (un des premiers gènes traduits) atteint une concentration assez élevée pour permettre l'exportation de l’ARN du VIH-1 non épissée ou partiellement épissée dans le cytoplasme. Les détails de la fonction de Rev et de ses actions réciproques sur le traitement d'ARN cellulaire et les machines d'exportation ne sont pas clairs. Pourtant, nous avons montré auparavant que Sam68 se lie tant au Rev qu'au RRE[1]. Quand Sam68 est surexprimé en présence du Rev, il agit en synergie avec ce dernier pour augmenter considérablement l'exportation de l’ARN contenant le RRE du noyau[1],[2]. La surexpression de Sam68 en absence de Rev facilite aussi l'exportation de l'ARN contenant le RRE[2].
Une étude a présenté la preuve que le "knock-down" de Sam68 par un ARNi a radicalement réduit l'expression de deux gènes dépendant de Rev. De plus, il a été constaté que la réduction de l’expression de Sam68 cause une inhibition très importante de production du VIH-1. Cette inhibition corrélée avec l'échec d'exporter de RRE contenant l'ARN de CAT et de l’ARNm viral dans les cellules ou Sam68 était réduit. Ceci indique que Sam68 est essentiel pour la fonction de Rev et pour la production du VIH-1.
Ces observations sont en accord avec les premières études qui ont employé des méthodes moins spécifiques pour réduire l'activité Sam68. En exprimant essentiellement une ARN antisens de la même longueur que Sam68, Li et al.[3] ont obtenu des réductions dans la réplication du VIH-1 de 80-86 %. Par contre, ils ne savaient pas si l'inhibition de l’expression de Sam68 était entièrement due à l’ARN antisens. D'autres protéines KH ont des degrés variables de similarité avec Sam68 et leur expression devrait être affectée par l'ARN antisens de Sam68. Comme montré précédemment[2], certaines de ces protéines KH peuvent améliorer l'expression des gènes Rev/RRE. Il était donc incertain si l'effet inhibiteur de l'ARN antisens de Sam68 était dû uniquement à l’effet obtenu sur Sam68. Inversement, la réplication résiduelle du VIH-1 en présence de l'ARN antisens de Sam68 pourrait être en raison de la capacité de ces protéines KH à compléter celle de Sam68. Aussi, un ARN antisens complet de Sam68 peut avoir des effets plus larges et plus compliqués que simplement faire taire le gène d'intérêt lorsqu’il est introduit dans les cellules. Par exemple, on a déterminé que les vecteurs d'expression d'antisens avaient modulé les effets de l’interféron-γ[4], qui peut à son tour affecter les fonctions cellulaires. On peut s'attend à ce que les effets de l’ARNi de Sam68 soient beaucoup plus spécifiques que l’effet de l’ARN antisens en raison de sa plus petite taille (19 bases contre 1.3 Ko). L’ARNi de Sam68 manquant d’homologie avec l’ARNm du KH et il est ainsi improbable qu'il vise l'expression de protéines KH. De plus, les protéines KH ne se lient pas à l’ARN RRE[2] et donc ces protéines échouent dans leur complémentation de Sam68 "knock-down" dans l'expression de gène RRE. Ainsi, l’ARNi de Sam68 s'est avéré être plus puissant que l'ARN antisens, en inhibant l’expression du gène post-transcriptionnelle du VIH-1 de 98-99 %.
Récemment, Coyle et al.[5] ont dit que Sam68 avait seulement un faible effet sur l'expression de gène Rev/RRE dans un système qui emploie le système RRE-gag. Il a été suggéré que les effets plus puissants de Sam68 sur Rev/RRE observés auparavant étaient en raison des faiblesses dans le système RRE-CAT. Pourtant, cette étude, qui a employé deux systèmes (le RRE-CAT et RRE-gag), réaffirme et étend les premiers résultats. De plus, afin de soutenir cette étude, Soros et autres[6] ont dit qu'en plus de Sam68, SLM1 et SLM2 stimulent eux aussi l'activité de Rev en utilisant trois différentes constructions de même correspondance (i.e. : CAT, gp120 et gag). La raison de la contradiction entre le rapport par Coyle et al.[5] et les autres études est peu évidente.
Finalement, Sam68 est une protéine nucléaire qui ne semble pas faire la navette entre le noyau et le cytoplasme[6]. Ceci amène la question à savoir comment une protéine localisée dans le noyau peut affecter l'exportation d'ARN RRE. Une protéine nucléaire de levure, Yrb2p, exemplifie un mécanisme possible[7]. Cette protéine, qui ne fait pas la navette, effectue l'exportation de protéine du noyau à un récepteur d'ordre nucléaire d'exportation, Xpo1p[7]. En cas du VIH, Sam68 communique avec le Rev[1],[3] et il est concevable que Sam68 puisse s’associer aux composantes d'exportation d'ARN (CRM1, Nup98 et Nup214) dans le noyau de façon directe ou indirecte et de promouvoir le transport intranucléaire de l'ARN viral au complexe de pores nucléaire et être retirée du complexe avant son exportation. À la lumière de ces conclusions, il serait important de déterminer laquelle des protéines du pore nucléaire s’associe avec Sam68 et joue un rôle dans l'exportation nucléaire de l’ARNm viral.
Notes et références
- Reddy T.R., Xu W., Mau J.K., Goodwin C.D., Suhasini M., Tang H., Frimpong K., Rose D.W., Wong-Staal F. Inhibition of HIV replication by dominant negative mutants of Sam68, a functional homologue of HIV-1 Rev. Nature Med. 1999;5:635–642. PMID
- Reddy T.R., Suhasini M., Xu W., Yeh L.Y., Yang J.P., Wu J., Artzt K., Wong-Staal F. A role for KH domain proteins (Sam68-like mammalian proteins and quaking proteins) in the post-transcriptional regulation of HIV replication. J. Biol. Chem. 2002;277:5778–5784. PMID
- Li J., Liu Y., Park I.W., He J.J. Direct participation of Sam68, the 68-kilodalton Src-associated protein in mitosis, in the CRM1-mediated Rev nuclear export pathway. J. Virol. 2002;76:4526–4535. PMID
- Delrue L., De Ley M. Modulation of the interferon-gamma signal by transfection of cells with an antisense-RNA expressing vector. Methods Mol. Biol. 2004;249:21–30. PMID
- Coyle J.H., Guzik B.W., Bor Y.C., Jin L., Eisner-Smerage L., Taylor S.J., Rekosh D., Hammarskjold M.L. Sam68 enhances the cytoplasmic utilization of intron-containing RNA and is functionally regulated by the nuclear kinase Sik/BRK. Mol. Cell. Biol. 2003;23:92–103. PMID
- Soros V.B., Carvajal H.V., Richard S., Cochrane A.W. Inhibition of human immunodeficiency virus type 1 Rev function by a dominant-negative mutant of Sam68 through sequestration of unspliced RNA at perinuclear bundles. J. Virol. 2001;75:8203–8215. PMID
- Taura T., Krebber H., Silver P.A. A member of the Ran-binding protein family, Yrb2p, is involved in nuclear protein export. Proc. Natl Acad. Sci. USA. 1998;95:7427–7432. PMID
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
Wikimedia Foundation. 2010.