- Règle du palier de Maxwell
-
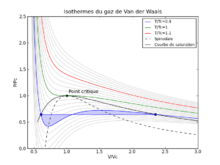
Soit un gaz réel; il se condense toujours : la règle indique la position du palier AB d'une isotherme d'un fluide pur, en coordonnées (V, P) (souvent appelées coordonnées de Clapeyron). VA désigne le volume molaire du liquide saturant et VB celui du volume molaire de la vapeur saturante. Soit le cycle monotherme (théorique) suivant : aller de A en B selon l'isotherme donné par l'équation d'état (voir gaz réel). Revenir de B en A par le palier. À supposer le cycle réversible, alors la règle de Maxwell est :

d'après le deuxième principe de la thermodynamique, énoncé de Thomson sur la non-existence du moteur monotherme. Ce raisonnement n'est pas rigoureux car sur une partie de l'isotherme, la compressibilité du fluide est négative, ce qui est interdit en thermodynamique, pour des raisons de stabilité. Un tel cycle ne saurait donc exister.
Néanmoins la règle peut se réécrire grâce à l'égalité (juste cette fois !)de l'enthalpie libre du gaz en B et de l'enthalpie libre du liquide en A.
Pour un gaz de Van der Waals, on peut effectuer complètement les calculs et on obtient , les valeurs de VA (T), de VB (T) et de pS(T), la pression de vapeur saturante. Les résultats sont qualitativement satisfaisants, ce qui est impressionnant car ON NE SAIT TOUJOURS PAS ACTUELLEMENT pourquoi l'eau bout à 100°C : quantitativement, il n'y a pas de théorie rigoureuse de l'état liquide et de la vaporisation. Donc le fait d'avoir, dès 1870, une équation qui donne une représentation qualitativement si proche de la réalité était un véritable tour-de-force.
On ajuste l'équation par des règles semi-empiriques variées (facteur acentrique, volume de cage, etc.): la variété des méthodes indique bien le piètre état de la théorie devant un problème aussi difficile.
Wikimedia Foundation. 2010.